1. בואו נעשה סכימת תגובה:
מטרות השיעור.חינוכית.הציגו לתלמידים את הסיווג החדש תגובה כימיתעל בסיס שינויים במצבי החמצון של יסודות - עם תגובות חיזור (ORD); ללמד את התלמידים לסדר מקדמים בשיטת האיזון האלקטרוני.
מתפתח.המשך פיתוח חשיבה לוגית, יכולת ניתוח והשוואה, היווצרות עניין בנושא.
חינוכית.לגבש תפיסת עולם מדעית של תלמידים; לשפר את כישורי העבודה.
שיטות וטכניקות מתודולוגיות.סיפור, שיחה, הדגמה של עזרים חזותיים, עבודה עצמאיתתלמידים.
ציוד וריאגנטים.רפרודוקציה המתארת את הקולוסוס של רודוס, האלגוריתם להצבת מקדמים לפי שיטת האיזון האלקטרוני, טבלת חומרי חמצון ומפחיתים אופייניים, תשבץ; Fe (מסמר), תמיסות של NaOH, CuSO4.
במהלך השיעורים
מבוא
(מוטיבציה והגדרת יעדים)
מוֹרֶה. במאה השלישית. לִפנֵי הַסְפִירָה. באי רודוס נבנתה אנדרטה בצורת פסל ענק של הליוס (בקרב היוונים - אל השמש). הרעיון הגרנדיוזי ושלמות הביצוע של הקולוסוס של רודוס - אחד מפלאי העולם - הדהימו את כל מי שראה אותו.
איננו יודעים איך בדיוק נראה הפסל, אך ידוע שהוא עשוי מברונזה והגיע לגובה של כ-33 מ'. הפסל נוצר על ידי הפסל הרט ובנייתו ארכה 12 שנים.
מעטפת הברונזה הוצמדה למסגרת הברזל. הפסל החלול החל להיבנות מלמטה וככל שגדל, הוא התמלא באבנים כדי להפוך אותו ליציב יותר. כ-50 שנה לאחר השלמת הבנייה, הקולוסוס קרס. במהלך רעידת האדמה הוא נשבר בגובה הברכיים.
מדענים מאמינים בכך סיבה אמיתיתהשבריריות של הנס הזה הייתה קורוזיה של המתכת. ובלב תהליך הקורוזיה נמצאות תגובות חיזור.
היום בשיעור תכירו תגובות חיזור; ללמוד על המושגים "חומר מצמצם" ו"חומר מחמצן", על תהליכי ההפחתה והחמצון; למד כיצד לסדר את המקדמים במשוואות של תגובות חיזור. כתוב בחוברות העבודה שלך את המספר, את נושא השיעור.
לימוד חומר חדש
המורה עורך שני ניסויי הדגמה: האינטראקציה של סולפט נחושת (II) עם אלקלי והאינטראקציה של אותו מלח עם ברזל.
מוֹרֶה. רשום את המשוואות המולקולריות של התגובות שבוצעו. בכל משוואה, סדר את מצבי החמצון של היסודות בנוסחאות של חומרי המוצא ותוצרי התגובה.
התלמיד כותב את משוואות התגובה על הלוח ומסדר את מצבי החמצון:
מוֹרֶה. האם מצבי החמצון של היסודות השתנו בתגובות אלו?
סטוּדֶנט. במשוואה הראשונה, מצבי החמצון של היסודות לא השתנו, אבל בשני הם השתנו - בנחושת ובברזל.
מוֹרֶה. התגובה השנייה היא חיזור. נסו להגדיר תגובות חיזור.
סטוּדֶנט. תגובות, שכתוצאה מהן משתנים מצבי החמצון של היסודות המרכיבים את המגיבים ותוצרי התגובה, נקראות תגובות חיזור.
התלמידים רושמים במחברת לפי הכתבה של המורה את ההגדרה של תגובות חיזור.
מוֹרֶה. מה קרה כתוצאה מתגובת החיזור? לפני התגובה, לברזל היה מצב חמצון של 0, לאחר התגובה הוא הפך ל-+2. כפי שאתה יכול לראות, מצב החמצון גדל, ולכן ברזל מוותר על 2 אלקטרונים.
לנחושת יש מצב חמצון של +2 לפני התגובה, ו-0 לאחר התגובה. כפי שניתן לראות, מצב החמצון ירד. לכן, נחושת מקבלת 2 אלקטרונים.
הברזל תורם אלקטרונים, הוא חומר מפחית, ותהליך העברת האלקטרונים נקרא חמצון.
נחושת מקבלת אלקטרונים, היא חומר מחמצן, ותהליך הוספת האלקטרונים נקרא הפחתה.
אנו כותבים את הסכמות של תהליכים אלה:
אז, תן את ההגדרה של המושגים "חומר מפחית" ו"חומר מחמצן".
סטוּדֶנט. אטומים, מולקולות או יונים התורמים אלקטרונים נקראים חומרים מפחיתים.
אטומים, מולקולות או יונים המקבלים אלקטרונים נקראים סוכני חמצון.
מוֹרֶה. מהי ההגדרה של תהליכי הפחתה וחמצון?
סטוּדֶנט. התאוששות היא תהליך של הוספת אלקטרונים לאטום, מולקולה או יון.
חמצון הוא התהליך שבו אלקטרונים מועברים על ידי אטום, מולקולה או יון.
התלמידים כותבים את ההגדרות במחברת בהכתבה ומשלימים את הציור.
זכור!
לתרום אלקטרונים - לחמצן.
קח אלקטרונים - התאושש.
מוֹרֶה. חמצון תמיד מלווה בהפחתה, ולהיפך, צמצום תמיד קשור לחמצון. מספר האלקטרונים שנתרם על ידי הגורם המחמצן שווה למספר האלקטרונים המחוברים על ידי חומר החמצון.
לבחירת המקדמים במשוואות תגובות החיזור, משתמשים בשתי שיטות - איזון אלקטרונים ואיזון אלקטרונים-יון (שיטת חצי תגובה).
נשקול רק את שיטת האיזון האלקטרוני. לשם כך, אנו משתמשים באלגוריתם לסידור המקדמים בשיטת האיזון האלקטרוני (משורטט על פיסת נייר ציור).
דוגמא מסדרים את המקדמים בסכימת תגובה זו בשיטת איזון האלקטרונים, קבעו את חומר החמצון והחומר המפחית, ציינו את תהליכי החמצון וההפחתה:
Fe2O3 + CO Fe + CO2.
נשתמש באלגוריתם להצבת המקדמים בשיטת האיזון האלקטרוני.
3. נכתוב את היסודות המשנים את דרגת החמצון:
4. חבר משוואות אלקטרוניות, קביעת מספר האלקטרונים הנתונים והמתקבלים:
5. מספר האלקטרונים הנתונים והמתקבלים חייב להיות זהה, כי לא המגיבים ולא תוצרי התגובה טעונים. אנו משווים את מספר האלקטרונים הנתונים והמתקבלים על ידי בחירת הכפולה הפחות משותפת (LCM) וגורמים נוספים:
6. המכפילים המתקבלים הם מקדמים. אנו מעבירים את המקדמים לערכת התגובה:
Fe2O3 + 3CO = 2Fe + 3CO2.
חומרים שהם חומרים מחמצנים או מפחיתים בתגובות רבות נקראים טיפוסיים.
מוצבת טבלה שנעשתה על גיליון Whatman.
מוֹרֶה. תגובות חיזור שכיחות מאוד. הם קשורים לא רק עם תהליכי קורוזיה, אלא גם עם תסיסה, ריקבון, פוטוסינתזה ותהליכים מטבוליים המתרחשים באורגניזם חי. ניתן לראות אותם במהלך הבעירה של דלק.
כיצד להשוות משוואה כימית: כללים ואלגוריתם
תהליכי חיזור מלווים את מחזורי החומרים בטבע.
האם ידעת שכ-2 מיליון טונות של חומצה חנקתית נוצרים באטמוספירה מדי יום, או
700 מיליון טון בשנה, ובצורת תמיסה חלשה נופלים לקרקע עם גשם (האדם מייצר רק 30 מיליון טון חומצה חנקתית בשנה).
מה קורה באטמוספירה?
אוויר מכיל 78% חנקן בנפח, 21% חמצן ו-1% גזים אחרים. תחת פעולת פריקות ברק, ובממוצע של 100 הבזקים בכדור הארץ בכל שנייה, מולקולות חנקן מתקשרות עם מולקולות חמצן ויוצרות תחמוצת חנקן (II):
תחמוצת החנקן (II) מתחמצנת בקלות על ידי חמצן אטמוספרי לחנקן תחמוצת (IV):
תחמוצת החנקן המתקבלת (IV) מקיימת אינטראקציה עם לחות אטמוספרית בנוכחות חמצן, והופכת לחומצה חנקתית:
NO2 + H2O + O2 HNO3.
כל התגובות הללו הן תגובות חיזור.
תרגיל . מסדרים את המקדמים בסכימות התגובה לעיל בשיטת האיזון האלקטרוני, ציינו את חומר החמצון, חומר הפחתת, החמצון וההפחתה.
פִּתָרוֹן
1. בואו נקבע את מצבי החמצון של היסודות:
2. אנו מדגישים את הסמלים של יסודות שמצבי החמצון שלהם משתנים:
3. בואו נכתוב את היסודות ששינו את מצבי החמצון שלהם:
4. חבר משוואות אלקטרוניות (קבע את מספר האלקטרונים הנתונים והמתקבלים):
5. מספר האלקטרונים שניתנו והמתקבלים זהה.
6. הבה נעביר את המקדמים ממעגלים אלקטרוניים לערכת התגובה:
לאחר מכן, הסטודנטים מוזמנים לסדר באופן עצמאי את המקדמים בשיטת האיזון האלקטרוני, לקבוע את חומר המחמצן, הגורם המפחית, לציין את תהליכי החמצון וההפחתה בתהליכים אחרים המתרחשים בטבע.
שתי משוואות התגובה האחרות (עם מקדמים) הן:
בדיקת נכונות המשימות מתבצעת באמצעות קודוסקופ.
חלק אחרון
המורה מבקש מהתלמידים לפתור תשבץ על סמך החומר הנלמד. תוצאת העבודה מוגשת לאימות.
לאחר ניחוש צְלָבִית, תגלה שהחומרים KMnO4, K2Cr2O7, O3 הם חזקים ... (לאורך האנכי (2)).
אופקי:
1. איזה תהליך משקפת התכנית:
3. תגובה
N2 (g.) + 3H2 (g.) 2NH3 (g.) + ש
הוא חיזור, הפיך, הומוגנית, … .
4. ... פחמן(II) הוא חומר מפחית טיפוסי.
5. איזה תהליך משקפת התכנית:
6. לבחירת מקדמים במשוואות תגובות חיזור, נעשה שימוש בשיטה של ... אלקטרוני.
7. לפי התרשים, האלומיניום נתן ... אלקטרון.
8. בתגובה:
H2 + Cl2 = 2HCl
מימן H2 - ... .
9. איזה סוג של תגובות הן תמיד רק תגובות חיזור?
10. מצב החמצון של חומרים פשוטים הוא ....
11. בתגובה:
מפחית...
שיעורי בית.
לפי ספר הלימוד של O.S. Gabrielyan "Chemistry-8" § 43, p. 178–179, לשעבר. 1, 7 בכתב. משימה (בבית). הבנאים של הראשון חלליותוצוללות התמודדו עם בעיה: איך לשמור על הרכב אוויר קבוע בספינה ו תחנות חלל? להיפטר מעודפי פחמן דו חמצני ולחדש חמצן? הפתרון נמצא.
אשלגן סופראוקסיד KO2 יוצר חמצן כתוצאה מאינטראקציה עם פחמן דו חמצני:
כפי שאתה יכול לראות, זוהי תגובת חיזור. חמצן הוא גם חומר מחמצן וגם חומר מפחית בתגובה זו.
במסע חלל, כל גרם מטען נחשב. חשב את אספקת האשלגן סופראוקסיד שיש לקחת לטיסה לחלל אם הטיסה מיועדת ל-10 ימים ואם הצוות מורכב משני אנשים. ידוע שאדם נושף 1 ק"ג פחמן דו חמצני ליום.
(תשובה. 64.5 ק"ג KO2. )
תרגיל ( רמה מוגבהתקשיים). רשום את המשוואות לתגובות החיזור שיכלו להוביל להרס הקולוסוס של רודוס. קחו בחשבון שהפסל הענק הזה ניצב בעיר נמל באי בים האגאי מול חופי טורקיה המודרנית, שבו האוויר הים תיכוני הלח רווי במלחים. הוא היה עשוי ברונזה (סגסוגת של נחושת ופח) ומותקן על מסגרת ברזל.
סִפְרוּת
Gabrielyan O.S.. כימיה-8. מוסקבה: Bustard, 2002;
Gabrielyan O.S., Voskoboynikova N.P., Yashukova A.V.מדריך של המורה. כיתה ח'. מוסקבה: Bustard, 2002;
קוקס ר., מוריס נ. שבעה פלאי העולם. עולם עתיק, ימי הביניים, זמננו. מ.: BMM AO, 1997;
אנציקלופדיה לילדים קטנים. כִּימִיָה. מ.: שותפות אנציקלופדית רוסית, 2001; אנציקלופדיה לילדים "אוונטה +". כִּימִיָה. ת' 17. מ': אוונטה+, 2001;
Khomchenko G.P., Sevastyanova K.I.תגובות חיזור. מוסקבה: חינוך, 1989.
ש"פ לבשבע,
מורה לכימיה מס' 8 בתיכון
(בלטיסק, אזור קלינינגרד)
כללים לבחירת מקדמים:
- אם מספר האטומים של יסוד בחלק אחד של סכימת התגובה הוא זוגי, ואי-זוגי בחלק השני, יש לשים את מקדם 2 לפני הנוסחה עם מספר אי זוגי של אטומים, ולאחר מכן את המספר של כולם יש להשוות אטומים.
- מיקום המקדמים צריך להתחיל עם החומר המורכב ביותר בהרכבו ולעשות זאת ברצף הבא:
ראשית עליך להשוות את מספר אטומי המתכת, אחר כך שיירים חומציים (אטומים שאינם מתכת), אחר כך אטומי מימן, ולבסוף, אטומי חמצן.
- אם מספר אטומי החמצן בחלק השמאלי והימני של המשוואה זהה, אז המקדמים נקבעים בצורה נכונה.
- לאחר מכן, ניתן להחליף את החץ בין חלקי המשוואה בסימן שוויון.
- למקדמים במשוואת התגובה הכימית אין מחלקים משותפים.
דוגמא. בואו נעשה משוואה לתגובה הכימית בין הידרוקסיד של ברזל (III) לחומצה גופרתית עם היווצרות של ברזל (III) סולפט.
1. בואו נעשה סכימת תגובה:
Fe(OH)3 + H2SO4 → Fe2(SO4)3 + H2O
2. נבחר את המקדמים לנוסחאות החומרים. אנו יודעים שעלינו להתחיל עם החומר המורכב ביותר ולהשוות באופן עקבי בכל הסכימה, תחילה את אטומי המתכת, אחר כך את שאריות החומצה, אחר כך את המימן, ולבסוף את החמצן. בתכנית שלנו, החומר המורכב ביותר הוא Fe2(SO4)3. הוא מכיל שני אטומי ברזל, ו-Fe(OH)3 מכיל אטום ברזל אחד. אז לפני הנוסחה Fe (OH) 3 יש צורך לשים את המקדם 2:
2Fe(OH)3 + H2SO4 → Fe2(SO4)3 + H2O
כעת אנו משווים את מספר שאריות החומצה SO4. מלח Fe2(SO4)3 מכיל שלוש שאריות חומצה SO4. אז, בצד שמאל, לפני הנוסחה H2SO4, שמנו את המקדם 3:
2Fe(OH)3 + 3H2SO4 → Fe2(SO4)3 + H2O.
כעת אנו משווים את מספר אטומי המימן. בצד שמאל של התרשים בברזל הידרוקסיד 2Fe (OH) 3 - 6 אטומי מימן (2
3), בחומצה גופרתית 3H2SO4 - גם 6 אטומי מימן.
איך מסדרים מקדמים במשוואות כימיות
בסך הכל, יש 12 אטומי מימן בצד שמאל. אז, בצד ימין, שמנו פקטור של 6 לפני נוסחת המים H2O - ועכשיו יש גם 12 אטומי מימן בצד ימין:
2Fe(OH)3 + 3H2SO4 → Fe2(SO4)3 + 6H2O.
נותר להשוות את מספר אטומי החמצן. אבל אתה לא צריך לעשות את זה יותר, כי בחלק השמאלי והימני של התרשים יש כבר אותו מספראטומי חמצן - 18 בכל חלק. זה אומר שהמעגל כתוב במלואו, ונוכל להחליף את החץ בסימן שוויון:
2Fe(OH)3 + 3H2SO4 = Fe2(SO4)3 + 6H2O.
חינוך
איך מסדרים מקדמים במשוואות כימיות? משוואות כימיות
היום נדבר על איך לסדר מקדמים במשוואות כימיות. שאלה זו מעניינת לא רק תלמידי תיכון. כללי מוסדות חינוך, אבל גם חבר'ה שרק מתוודעים למרכיבים הבסיסיים של קומפלקס ו מדע מעניין. אם בשלב הראשון תבינו איך כותבים משוואות כימיות, בעתיד לא יהיו בעיות בפתרון בעיות. בואו נעשה את זה נכון מההתחלה.
מהי משוואה
בכך נהוג להתכוון לתיעוד מותנה של תגובה כימית המתרחשת בין הריאגנטים שנבחרו. לתהליך כזה משתמשים במדדים, מקדמים, נוסחאות.
אלגוריתם קומפילציה
איך כותבים משוואות כימיות? ניתן לכתוב דוגמאות לכל אינטראקציה על ידי סיכום התרכובות המקוריות. סימן השוויון מציין שיש אינטראקציה בין החומרים המגיבים. לאחר מכן, מורכבת נוסחה למוצרים לפי ערכיות (מצב חמצון).
סרטונים קשורים
כיצד לרשום תגובה
לדוגמה, אם אתה צריך לרשום משוואות כימיות המאשרות את תכונות המתאן, בחר את האפשרויות הבאות:
- הלוגנציה (אינטראקציה רדיקלית עם אלמנט VIIA של הטבלה המחזורית של D. I. מנדלייב);
- בעירה בחמצן אטמוספרי.

במקרה הראשון, אנו כותבים את החומרים ההתחלתיים בצד שמאל, ואת המוצרים המתקבלים בצד ימין. לאחר בדיקת מספר האטומים של כל יסוד כימי, אנו מקבלים את התיעוד הסופי של התהליך המתמשך. כאשר מתאן נשרף בחמצן אטמוספרי, מתרחש תהליך אקסותרמי, כתוצאה ממנו נוצרים פחמן דו חמצני ואדי מים.
על מנת לשים נכון את המקדמים במשוואות כימיות, נעשה שימוש בחוק שימור המסה של חומרים. אנו מתחילים את תהליך ההתאמה על ידי קביעת מספר אטומי הפחמן. לאחר מכן, אנו מבצעים חישובים למימן ורק לאחר מכן בודקים את כמות החמצן.
OVR
ניתן להשוות משוואות כימיות מורכבות באמצעות שיטת איזון אלקטרוני או חצי תגובות. אנו מציעים רצף של פעולות שנועדו לסדר את המקדמים בתגובות מהסוגים הבאים:

ראשית, חשוב לסדר את מצב החמצון של כל יסוד בתרכובת. בעת הצבת אותם, יש צורך לקחת בחשבון כמה כללים:
- עבור חומר פשוט, הוא שווה לאפס.
- בתרכובת בינארית, הסכום שלהם הוא 0.
- בתרכובת של שלושה יסודות או יותר, לראשון יש ערך חיובי, וליון האחרון יש ערך שלילי של מצב החמצון. האלמנט המרכזי מחושב מתמטית, בהינתן שהסכום צריך להיות 0.
לאחר מכן, נבחרים האטומים או היונים שעבורם השתנה מצב החמצון. סימני הפלוס והמינוס מראים את מספר האלקטרונים (מקובל, נמסר). לאחר מכן, הכפולה הקטנה ביותר נקבעת ביניהם. כאשר מחלקים את ה-NOC במספרים אלו, מתקבלים המספרים. אלגוריתם זה יהיה התשובה לשאלה כיצד לסדר את המקדמים במשוואות כימיות.
דוגמה ראשונה
נניח שהמשימה ניתנת: "סדרו את המקדמים בתגובה, מלאו את החסר, קבעו את חומר החמצון והחומר המצמצם". דוגמאות כאלה מוצעות לבוגרי בית ספר שבחרו בכימיה כבחינה.
KMnO4 + H2SO4 + KBr = MnSO4 + Br2 +…+…

בואו ננסה להבין כיצד לסדר את המקדמים במשוואות הכימיות המוצעות למהנדסים ורופאים עתידיים. לאחר סידור מצבי החמצון של היסודות בחומרי המוצא ובתוצרים הזמינים, אנו מגלים שיון המנגן פועל כחומר מחמצן, ויון הברומיד מפגין תכונות מפחיתות.
אנו מסיקים שהחומרים החסרים אינם משתתפים בתהליך החיזור. אחד המוצרים החסרים הוא מים, והשני יהיה אשלגן גופרתי. לאחר הרכבת המאזן האלקטרוני, השלב האחרון יהיה קביעת המקדמים במשוואה.
דוגמה שניה
בוא ניתן דוגמה נוספת כדי להבין איך מסדרים את המקדמים במשוואות הכימיות מסוג חיזור.
נניח שיש לנו את הסכימה הבאה:
P + HNO3 = NO2 +…+…
זרחן, שלפי מוסכמה הוא חומר פשוט, מפגין תכונות מפחיתות, ומעלה את מצב החמצון ל-+5. לכן, אחד החומרים החסרים יהיה חומצה זרחתית H3PO4. OVR מניח נוכחות של חומר מפחית, שיהיה חנקן. זה נכנס לתחמוצת חנקן (4) ויוצר NO2

על מנת לשים את המקדמים בתגובה זו, נבצע איזון אלקטרוני.
P0 נותן 5e = P+5
N+5 לוקח e = N+4
בהינתן שחייבים להקדים את חומצה חנקתית ותחמוצת חנקן (4) בפקטור 5, אנו מקבלים את התגובה המוגמרת:
P + 5HNO3 = 5NO2 + H2O + H3PO4
מקדמים סטריאוכימיים בכימיה מאפשרים פתרון בעיות חישוביות שונות.
דוגמה שלישית
בהתחשב בכך ששיבוץ המקדמים גורם לקשיים עבור תלמידי תיכון רבים, יש צורך לחשב את רצף הפעולות באמצעות דוגמאות ספציפיות. אנו מציעים דוגמה נוספת למשימה, שמימושה דורש שליטה בשיטת סידור המקדמים בתגובת החיזור.
H2S + HMnO4 = S + MnO2 +…

המוזרות של המשימה המוצעת היא שיש צורך להשלים את תוצר התגובה החסר, ורק לאחר מכן אתה יכול להמשיך לקביעת המקדמים.
לאחר סידור מצבי החמצון של כל יסוד בתרכובות, ניתן להסיק כי מנגן, המוריד את הערכיות, מפגין תכונות חמצון. גופרית מדגים את יכולת ההפחתה בתגובה המוצעת, כשהיא מופחתת לחומר פשוט. לאחר עריכת המאזן האלקטרוני, נצטרך רק למקם את המקדמים בסכימת התהליך המוצעת. והמעשה נעשה.
דוגמה רביעית
משוואה כימית נקראת תהליך שלם כאשר היא מכילה במלואוחוק שימור המסה מתקיים. איך בודקים את הדפוס הזה? מספר האטומים מאותו סוג שנכנסו לתגובה חייב להתאים למספרם בתוצרי האינטראקציה. רק במקרה זה ניתן יהיה לדבר על התועלת של האינטראקציה הכימית המתועדת, על אפשרות היישום שלה לחישובים, פתרון בעיות חישוביות ברמות שונות של מורכבות. הנה גרסה של המשימה, הכוללת סידור המקדמים הסטריאוכימיים החסרים בתגובה:
Si + …+ HF = H2SiF6 + NO +…

המורכבות של המשימה היא שהן חומרי המוצא והן תוצרי האינטראקציה מושמטים. לאחר הגדרת כל האלמנטים של מצבי החמצון, אנו רואים שאטום הסיליקון מציג תכונות מפחיתות במשימה המוצעת. חנקן (II) קיים בין תוצרי התגובה, אחת התרכובות ההתחלתיות היא חומצה חנקתית. באופן הגיוני, אנו קובעים שהתוצר החסר של התגובה הוא מים. השלב האחרון יהיה סידור המקדמים הסטריאוכימיים המתקבלים בתגובה.
3Si + 4HNO3 + 18HF = 3H2SiF6 + 4NO + 8H2O
דוגמה לבעיה במשוואה
יש צורך לקבוע את הנפח של תמיסה 10% של מימן כלורי, שצפיפותה היא 1.05 גרם / מ"ל, הכרחי לנטרול מוחלט של סידן הידרוקסיד שנוצר במהלך ההידרוליזה של הקרביד שלו. ידוע כי הגז המשתחרר במהלך הידרוליזה תופס נפח של 8.96 ליטר (נ.א.).
CaC2 + 2H2O = Ca(OH)2 + C2H2
סידן הידרוקסיד יוצר אינטראקציה עם מימן כלורי, ניטרול מלא מתרחש:
Ca(OH)2 + 2HCl = CaCl2 + 2H2O

אנו מחשבים את מסת החומצה הדרושה לתהליך זה.
מקדמים ומדדים במשוואות כימיות
קבע את נפח תמיסת מימן כלורי. כל החישובים לבעיה מבוצעים תוך התחשבות במקדמים סטריאוכימיים, המאשרים את חשיבותם.
סוף כל סוף
ניתוח של תוצאות הבחינה המאוחדת בכימיה מצביע על כך שמטלות הקשורות לקביעת מקדמים סטריאוכימיים במשוואות, יצירת איזון אלקטרוני, קביעת חומר מחמצן וחומר מפחית גורמות לקשיים רציניים עבור בוגרי בתי ספר תיכוניים מודרניים. למרבה הצער, מידת העצמאות של הבוגרים המודרניים היא כמעט מינימלית, ולכן תלמידי תיכון אינם עובדים על הבסיס התיאורטי שהציע המורה.
בין טעויות נפוצות, שתלמידי בית הספר מאפשרים על ידי הצבת המקדמים בתגובות סוג אחר, שגיאות מתמטיות רבות. למשל, לא כולם יודעים למצוא את הכפולה הפחות משותפת, לחלק ולהכפיל נכון מספרים. הסיבה לתופעה היא הירידה במספר השעות המוקדשות בתי ספר חינוכייםללמוד את הנושא הזה. בְּ תוכנית בסיסיתבכימיה, למורים אין הזדמנות לברר עם תלמידיהם נושאים הקשורים להרכבת איזון אלקטרוני בתהליך החיזור.
חינוך
מה זה ריבוע? איך למצוא את הקודקודים, החתך, המישור, המשוואה, הנפח, שטח הבסיס והזווית של ריבוע?
יכולות להיות תשובות רבות לשאלה מהו ריבוע. הכל תלוי למי אתה שואל את השאלה הזו. המוזיקאי יגיד שריבוע הוא 4, 8, 16, 32 תיבות או אלתור ג'אז. ילד - מה זה...
מכוניות
באיזו תדירות להחליף נוזל לרדיאטור במכונית?
במהלך פעולת מנוע המכונית, טמפרטורת הגזים בתוך הצילינדרים שלו מגיעה ל-2000 מעלות. בגלל זה, יש חימום חזק של חלקי יחידת הכוח. על מנת להסיר עודפי חום מהמנוע, ...
מכוניות
כיצד פועל תרמוסטט לרכב? עקרון הפעולה
אף אחד מכונית מודרניתלא בלי מערכת קירור. היא זו שלוקחת על עצמה את כל החום הנובע מהמנוע במהלך עיבוד התערובת הדליקה. הבוכנות זזות, התערובת בוערת, בהתאמה, אתה צריך טוב ...
מכוניות
איך למלא את המזגן במכונית במו ידיך? באיזו תדירות עלי למלא את המזגן במכונית שלי? היכן ניתן להטעין את המזגן ברכב?
מיזוג אוויר לרכב הוא לא רק מותרות היום, אלא מכשיר רכב הכרחי שאחראי על מיקרו אקלים נוח בתא הנוסעים. כמעט כל דגמים מודרנייםמכוניות מצוידות, אם לא אקלים...
מכוניות
איך לנקות את המזגן במכונית במו ידיך?
בעלי רכב חייבים לדאוג כל הזמן למצבם של החלקים והמנגנונים העיקריים של הרכב שלהם. אחרי הכל, שמירה על ניקיון ובמצב טוב מאפשרת לך להגיע לרמת בטיחות אופטימלית...
מכוניות
שמן גיר 80W90: מאפיינים, מבחר, ביקורות. איזה שמן למלא בתיבת הילוכים ידנית?
שמן גיר 80W90, שאת מאפייניו נשקול היום, ניתן לייחס לממוצע בין דרגות הצמיגות 85W90 ו-75W90. בואו לגלות ביתר פירוט מה המאפיינים האיכותיים שהוא שונה זה מזה ...
מכוניות
איזה שמן למלא בהגה הכוח? טיפים להחלפת שמן הגה כוח
הגה הכוח, כמו שאר הרכיבים והמכלולים של המכונית, דורש תחזוקה תקופתית. לרוב כולם פעולות מניעהמופחת להחלפת נוזל העבודה. לעתים קרובות אתה רק צריך...
מכוניות
איך לשלם עבור חניה במוסקבה? כללים חניה בתשלום
ישנם כללים לחניה בתשלום, שנוצרו על מנת להקל על הנהג במוסקבה. זה לא סוד שחניה רכבזה לא קל בבירה: צדי הכבישים של העיר עמוסים ב...
מכוניות
איך להכין ניחוחות במכונית במו ידיך
כל בעל רכב רוצה שארומה נעימה ואהובה תהיה נוכחת תמיד בתא של סוס הברזל שלו. מישהו אוהב ריח של קפה, מישהו אוהב פירות הדר, ומישהו אוהב טריות. איזה טעמים...
מכוניות
איך לטעון את הסוללה בבית?
כנראה שכל בעל רכב התמודד עם הבעיה של מצבר מת. בעיה זו יכולה לקרות לכל נהג אם לא תשים לב מספיק למקור הכוח של המכונית. נדבר על...
אופציה 1
א) Na + O2 -> Na2O d) H2 + F2 -> HF
ב) CaCO3-> CaO + CO2 ה) H2O + K2O -> KOH
ג) Zn + H2SO4 -> H2 + ZnSO4 f) Cu(OH)2 + HNO3 -> Cu(NO3)2 + H2O
שיעור 13
רשום את ההגדרות:
א) תגובה מורכבת ב) תגובה אקסותרמית ג) תגובה בלתי הפיכה.
א) פחמן יוצר אינטראקציה עם חמצן ונוצר פחמן חד חמצני (II);
ב) תחמוצת מגנזיום מקיימת אינטראקציה עם חומצה חנקתית ונוצרים מגנזיום חנקתי ומים;
ג) הידרוקסיד של ברזל (III) מתפרק לתחמוצת ברזל (III) ומים;
ד) מתאן CH4 נשרף בחמצן ונוצרים פחמן חד חמצני (IV) ומים;
ה) תחמוצת חנקן (V) כאשר היא מומסת במים יוצרת חומצה חנקתית.
4. פתור את הבעיה לפי המשוואה:
א) איזה נפח מימן פלואוריד נוצר כאשר מימן מגיב עם פלואור?
ב) איזו מסה של תחמוצת סידן נוצרת במהלך פירוק אבן גיר המכילה 80% CaCO3?
ג) איזה נפח ומסה של מימן ישתחררו בעת אינטראקציה עם חומצה גופרתית אבץ המכילה 35% זיהומים?
אפשרות 2
- סדרו את המקדמים, קבעו את סוג התגובה הכימית, רשמו את שמות החומרים בנוסחאות:
א) P + O2 -> P2O5 ד) H2 + N2 -> NH3
ב) CaCO3 + HCl -> CaCl2 + H2O + CO2 ה) H2O + Li2O -> LiOH
ג) Mg + H2SO4 -> H2 + MgSO4 e) Ca(OH)2 + HNO3 -> Ca(NO3)2 + H2O
2. רשום את ההגדרות:
א) תגובת פירוק ב) תגובה אנדותרמית ג) תגובה קטליטית.
3. רשמו את המשוואות לפי התיאור:
א) פחמן יוצר אינטראקציה עם חמצן ונוצר פחמן חד חמצני (IV);
ב) תחמוצת בריום מגיבה עם חומצה חנקתית ונוצרים בריום חנקתי ומים;
ג) אלומיניום הידרוקסיד מתפרק לתחמוצת אלומיניום ומים;
ד) נוצרות כוויות אמוניה NH3 בחמצן ובחנקן ובמים;
ה) תחמוצת זרחן (V), כאשר היא מומסת במים, יוצרת חומצה זרחתית.
4. פתרו את הבעיה לפי המשוואה:
א) איזה נפח אמוניה נוצר כאשר מימן מגיב עם חנקן?
ב) איזו מסה של סידן כלוריד נוצרת בעת אינטראקציה עם חומצה הידרוכלוריתשיש המכיל 80% CaCO3?
ג) איזה נפח ומסה של מימן ישתחררו בעת אינטראקציה עם חומצה גופרתית מגנזיום המכילה 30% זיהומים?
 איך כותבים משוואות כימיות? ראשית, חשוב לסדר את מצב החמצון של כל יסוד בתרכובת. נניח שהמשימה ניתנת: "סדרו את המקדמים בתגובה, מלאו את החסר, קבעו את חומר החמצון והחומר המצמצם". אחד המוצרים החסרים הוא מים, והשני יהיה אשלגן גופרתי. לאחר הרכבת המאזן האלקטרוני, השלב האחרון יהיה קביעת המקדמים במשוואה. כל החישובים לבעיה מבוצעים תוך התחשבות במקדמים סטריאוכימיים, המאשרים את חשיבותם. בין הטעויות האופייניות שתלמידי בית הספר עושים בהצבת מקדמים בתגובות מסוגים שונים, ישנן טעויות מתמטיות רבות.
איך כותבים משוואות כימיות? ראשית, חשוב לסדר את מצב החמצון של כל יסוד בתרכובת. נניח שהמשימה ניתנת: "סדרו את המקדמים בתגובה, מלאו את החסר, קבעו את חומר החמצון והחומר המצמצם". אחד המוצרים החסרים הוא מים, והשני יהיה אשלגן גופרתי. לאחר הרכבת המאזן האלקטרוני, השלב האחרון יהיה קביעת המקדמים במשוואה. כל החישובים לבעיה מבוצעים תוך התחשבות במקדמים סטריאוכימיים, המאשרים את חשיבותם. בין הטעויות האופייניות שתלמידי בית הספר עושים בהצבת מקדמים בתגובות מסוגים שונים, ישנן טעויות מתמטיות רבות.
ישנם כללים מסוימים שלפיהם ניתן לקבוע אותם עבור כל אלמנט. לנוסחאות המורכבות משלושה יסודות יש ניואנסים משלהן לחישוב מצבי חמצון. בואו נמשיך את השיחה על איך להשוות משוואות כימיות בשיטת איזון האלקטרונים. תנאי מוקדם הוא לבדוק את המספר של כל אלמנט בחלק השמאלי והימני. אם המקדמים ממוקמים נכון, מספרם צריך להיות זהה.
שיטה אלגברית
הקפד לקרוא על ניתוח אלמנטים עבור מבט מפורט על נוסחאות אמפיריות וניתוח כימי.
הכימיה חוקרת חומרים, תכונותיהם ותמורותיהם. בצורה מולקולרית, תהליך שריפת הברזל באטמוספירה יכול לבוא לידי ביטוי באמצעות סימנים וסמלים. לפי חוק שימור מסת החומרים יש לשים לפני נוסחת המוצר פקטור 2. לאחר מכן בודקים סידן. מלכתחילה, עבור כל אחד מהיסודות בחומרים ההתחלתיים ובתוצרי האינטראקציה, נציב את ערכי מצבי החמצון. השלב הבא הוא בדיקת המימן.
השוואת תגובות כימיות
השוואת תגובות כימיות נחוצה על מנת להשיג תגובות כימיות שלמות ממשוואה כימית פשוטה. נתחיל עם פחמן.
חוק שימור המסה אינו כולל הופעת אטומים חדשים והרס של אטומים ישנים במהלך תגובה כימית. שימו לב לאינדקס של כל אחד מהאטומים, הוא זה שמציין את מספרם. על ידי הוספת מדדים מול מולקולות החומרים בצד ימין של המשוואה, שינינו גם את מספר אטומי החמצן. כעת המספר של כל אטומי הפחמן, המימן והחמצן זהה בשני הצדדים של המשוואה.
אומרים שאם הגורם נמצא מחוץ לסוגריים, אז כל רכיב בסוגריים מוכפל בו. אתה צריך להתחיל עם חנקן, מכיוון שהוא פחות מחמצן ומימן. נהדר, מימן השווה. הבא הוא בריום. הוא מפולס, אין צורך לגעת בו. לפני התגובה, יש שני כלור, אחריו - רק אחד. מה שצריך להיעשות? כעת, עקב המקדם שנקבע זה עתה, לאחר התגובה התקבלו שני נתרן ולפני התגובה גם שניים. נהדר, כל השאר מאוזן. השלב הבא הוא לסדר את מצבי החמצון של כל היסודות בכל חומר על מנת להבין היכן התרחש החמצון והיכן התרחשה ההפחתה.

דוגמה לניתוח תגובות פשוטות
מ צד ימיןאין מדדים, כלומר חלקיק חמצן אחד, ומשמאל - 2 חלקיקים. לא ניתן לבצע מדדים או תיקונים נוספים לנוסחה הכימית, מכיוון שהיא כתובה נכון. בצד ימין, נכפיל אחד ב-2 כדי לקבל גם שם 2 יוני חמצן.
לפני שתמשיך למשימה עצמה, עליך ללמוד שהמספר שממוקם מול יסוד כימי או הנוסחה כולה נקרא מקדם. אנחנו מתחילים לנתח. לפיכך, התברר אותו מספר אטומים של כל יסוד לפני ואחרי סימן השוויון. הקפידו לזכור שהמקדם מוכפל במדד, ולא מתווסף.
אתה חופשי להשתמש בכל מסמך למטרות שלך, בכפוף לתנאים הבאים:
2) סמלים יסודות כימייםיש לכתוב אך ורק בצורה שבה הם מופיעים בטבלה המחזורית.
כרטיס מידע. "אלגוריתם למיקום מקדמים במשוואות של תגובות כימיות."
3) מדי פעם נוצרים מצבים שבהם הנוסחאות של המגיבים והתוצרים כתובים בצורה נכונה לחלוטין, אך המקדמים עדיין לא ממוקמים. ההתרחשות הסבירה ביותר של בעיה כזו היא עם תגובות חמצון של חומרים אורגניים שבהם שלד הפחמן נקרע.
משוואת התגובה חייבת להיות מסוגלת לא רק לכתוב, אלא גם לקרוא. לכן, לפעמים, לאחר שרשמנו את כל הנוסחאות במשוואת התגובה, יש צורך להשוות את מספר האטומים בכל חלק של המשוואה - לסדר את המקדמים. ספור האם האטומים של כל יסוד שווים בצד שמאל וימין של המשוואה.
עבור תלמידי בית ספר רבים, כתיבת משוואות התגובות הכימיות וסידור נכון של המקדמים אינה משימה קלה. אבל אתה רק צריך לזכור כמה כללים פשוטים, והמשימה כבר לא תגרום לקשיים. המקדם, כלומר המספר שלפני הנוסחה של המולקולה כִּימִי, חל על כל התווים, ומוכפל בכל אינדקס של כל תו!
משוואת תגובה בכימיה היא תיעוד של תהליך כימי באמצעות נוסחאות כימיותוסמלים מתמטיים.
תיעוד כזה הוא סכימה של תגובה כימית. כאשר הסימן "=" מופיע, זה נקרא "משוואה". בואו ננסה לפתור את זה.
דוגמה לניתוח תגובות פשוטות
לסידן יש אטום אחד, מכיוון שהמקדם לא שווה את זה. גם האינדקס לא כתוב כאן, מה שאומר שהוא אחד. בצד ימין של המשוואה, Ca הוא גם אחד. אנחנו לא צריכים לעבוד על סידן.
אנו מסתכלים על היסוד הבא - חמצן. אינדקס 2 מציין שיש 2 יוני חמצן. אין מדדים בצד ימין, כלומר חלקיק חמצן אחד, ובצד שמאל - 2 חלקיקים. מה אנחנו עושים? לא ניתן לבצע מדדים או תיקונים נוספים לנוסחה הכימית, מכיוון שהיא כתובה נכון.
המקדמים הם מה שכתוב לפני החלק הקטן ביותר. יש להם את הזכות לשנות. מטעמי נוחות, איננו משכתבים את הנוסחה עצמה. בצד ימין, נכפיל אחד ב-2 כדי לקבל גם שם 2 יוני חמצן.

לאחר שקבענו את המקדם, קיבלנו 2 אטומי סידן. יש רק אחד בצד שמאל. אז עכשיו אנחנו צריכים לשים 2 לפני הסידן.

עכשיו בואו נבדוק את התוצאה. אם מספר אטומי היסוד שווה בשני הצדדים, אז נוכל לשים סימן "שווה".

אַחֵר דוגמה טובה: שני מימנים משמאל, ואחרי החץ יש לנו גם שני מימנים.

- שני חמצן לפני החץ, ואחרי החץ אין מדדים, כלומר אחד.
- יותר בשמאל, פחות בימין.
- שמנו פקטור 2 מול המים.

הכפלנו את כל הנוסחה ב-2, ועכשיו שינינו את כמות המימן. נכפיל את המדד במקדם, ומסתבר 4. ובצד שמאל יש שני אטומי מימן. וכדי לקבל 4, עלינו להכפיל את המימן בשניים.

הנה המקרה כאשר האלמנט בנוסחה האחת והשנייה נמצא מצד אחד, עד החץ.

יון גופרית אחד משמאל ויון גופרית אחד מימין. שני חלקיקי חמצן, ועוד שני חלקיקי חמצן. אז יש 4 חמצן בצד שמאל. בצד ימין יש 3 חמצן. כלומר, מצד אחד מתקבל מספר זוגי של אטומים, ומצד שני מספר אי-זוגי. אם נכפיל מספר אי זוגי ב-2, נקבל מספר זוגי. קודם כל מביאים אותו לערך שווה. לשם כך, הכפילו בשניים את כל הנוסחה שאחרי החץ. לאחר הכפל, נקבל שישה יוני חמצן, ואפילו 2 אטומי גופרית. בצד שמאל, יש לנו חלקיק אחד של גופרית. עכשיו בואו נשווה את זה. שמנו משוואות בצד שמאל לפני האפור 2.

שקוראים לו.
תגובות מורכבות
הדוגמה הזו יותר מסובכת כי כאן עוד פריטיםחומרים.

זה נקרא תגובת נטרול. מה צריך להשוות כאן קודם כל:
- בצד שמאל נמצא אטום נתרן אחד.
- בצד ימין, המדד אומר שיש 2 נתרן.
המסקנה מעידה על עצמה שיש צורך להכפיל את כל הנוסחה בשניים.

עכשיו בואו נראה כמה גופרית. אחד בצד שמאל וימין. שימו לב לחמצן. בצד שמאל יש לנו 6 אטומי חמצן. מצד שני - 5. פחות בימין, יותר בשמאל. יש להביא מספר אי-זוגי לערך זוגי. לשם כך, נכפיל את נוסחת המים ב-2, כלומר, אנו יוצרים 2 מאטום חמצן אחד.
עכשיו בצד ימין יש כבר 6 אטומי חמצן. יש גם 6 אטומים בצד שמאל. בדיקת מימן. שני אטומי מימן ועוד 2 אטומי מימן. כלומר, יהיו ארבעה אטומי מימן בצד שמאל. ובצד השני גם ארבעה אטומי מימן. כל האלמנטים מאוזנים. שמנו סימן "שוויון".

הדוגמה הבאה.

כאן הדוגמה מעניינת בכך שהופיעו סוגריים. אומרים שאם הגורם נמצא מחוץ לסוגריים, אז כל רכיב בסוגריים מוכפל בו. אתה צריך להתחיל עם חנקן, מכיוון שהוא פחות מחמצן ומימן. בצד שמאל יש חנקן אחד, ומימין, תוך התחשבות בסוגריים, יש שניים.

יש שני אטומי מימן בצד ימין, אבל יש צורך בארבעה. אנחנו יוצאים מהמצב פשוט על ידי הכפלת המים בשניים, וכתוצאה מכך ארבעה מימנים. נהדר, מימן השווה. נשאר חמצן. לפני התגובה, יש 8 אטומים, אחרי - גם 8.
נהדר, כל האלמנטים שווים, אנחנו יכולים לשים "שווה".

דוגמה אחרונה.

הבא הוא בריום. הוא מפולס, אין צורך לגעת בו. לפני התגובה, יש שני כלור, אחריו - רק אחד. מה שצריך להיעשות? שים 2 לפני כלור לאחר התגובה.

כעת, עקב המקדם שנקבע זה עתה, לאחר התגובה התקבלו שני נתרן ולפני התגובה גם שניים. נהדר, כל השאר מאוזן.

ניתן להשוות את התגובות גם בשיטת האיזון האלקטרוני. לשיטה זו יש מספר כללים לפיהם ניתן ליישם אותה. השלב הבא הוא לסדר את מצבי החמצון של כל היסודות בכל חומר על מנת להבין היכן התרחש החמצון והיכן התרחש ההפחתה.
כדי להבין איך להשוות משוואה כימית, ראשית עליך לברר את מטרת המדע הזה.
הַגדָרָה
הכימיה חוקרת חומרים, תכונותיהם ותמורותיהם. אם אין שינוי בצבע, משקעים, שחרור של חומר גזי, אז לא מתרחשת אינטראקציה כימית.
לדוגמה, כאשר מסמר ברזל עם פצירה, המתכת פשוט הופכת לאבקה. במקרה זה, לא מתרחשת תגובה כימית.
ההסתיידות של פרמנגנט אשלגן מלווה ביצירת תחמוצת מנגן (4), שחרור חמצן, כלומר נצפית אינטראקציה. במקרה זה, מתעוררת שאלה טבעית לחלוטין כיצד להשוות נכון משוואות כימיות. ננתח את כל הניואנסים הקשורים להליך כזה.

ספציפיות של טרנספורמציות כימיות
כל תופעה המלווה בשינוי בהרכב האיכותי והכמותי של החומרים מתייחסת ל טרנספורמציות כימיות. בצורה מולקולרית, תהליך שריפת הברזל באטמוספירה יכול לבוא לידי ביטוי באמצעות סימנים וסמלים.
שיטת הצבת המקדמים
כיצד להשוות מקדמים במשוואות כימיות? במהלך של כימיה בית ספר תיכוןמבין את שיטת האיזון האלקטרוני. בואו נשקול את התהליך ביתר פירוט. מלכתחילה, בתגובה הראשונית, יש צורך לסדר את מצבי החמצון של כל יסוד כימי.
ישנם כללים מסוימים שלפיהם ניתן לקבוע אותם עבור כל אלמנט. בחומרים פשוטים, מצבי החמצון יהיו אפס. בתרכובות בינאריות, ליסוד הראשון יש ערך חיובי, המתאים לערך הגבוה ביותר. עבור האחרונים, פרמטר זה נקבע על ידי הפחתת מספר הקבוצה משמונה ויש לו סימן מינוס. לנוסחאות המורכבות משלושה יסודות יש ניואנסים משלהן לחישוב מצבי חמצון.
עבור היסוד הראשון והאחרון, הסדר דומה להגדרה בתרכובות בינאריות, ונעשה משוואה לחישוב היסוד המרכזי. הסכום של כל האינדיקטורים חייב להיות שווה לאפס, על סמך זה מחושב האינדיקטור עבור האלמנט האמצעי של הנוסחה.
בואו נמשיך את השיחה על איך להשוות משוואות כימיות בשיטת איזון האלקטרונים. לאחר קביעת מצבי החמצון, ניתן לקבוע את אותם יונים או חומרים ששינו את ערכם במהלך האינטראקציה הכימית.
סימני הפלוס והמינוס מציינים את מספר האלקטרונים שהתקבלו (נמסרו) בתהליך האינטראקציה הכימית. בין המספרים שהתקבלו, מצא את הכפולה המשותפת הפחותה.
כאשר מחלקים אותו לאלקטרונים שנקלטו ונתונים, מתקבלים מקדמים. איך לאזן משוואה כימית? יש להציב את הנתונים המתקבלים במאזן מול הנוסחאות המתאימות. תנאי מוקדם הוא לבדוק את המספר של כל אלמנט בחלק השמאלי והימני. אם המקדמים ממוקמים נכון, מספרם צריך להיות זהה.

חוק שימור מסה של חומרים
מתווכחים כיצד להשוות משוואה כימית, יש צורך להשתמש בחוק זה. בהתחשב בכך שהמסה של אותם חומרים שנכנסו לתגובה כימית שווה למסה של התוצרים המתקבלים, אפשר לקבוע מקדמים מול הנוסחאות. למשל, איך להשוות משוואה כימית אם חומרים פשוטים סידן וחמצן מתקשרים, ולאחר השלמת התהליך מתקבלת תחמוצת?
כדי להתמודד עם המשימה יש לקחת בחשבון שחמצן הוא מולקולה דיאטומית בעלת קשר קוולנטי לא קוטבי, ולכן הנוסחה שלה כתובה בצורה הבאה - O2. בצד ימין, בעת קומפילציה של תחמוצת סידן (CaO), נלקחות בחשבון הערכיות של כל יסוד.
ראשית עליך לבדוק את כמות החמצן בכל חלק של המשוואה, שכן היא שונה. לפי חוק שימור מסת החומרים יש לשים לפני נוסחת המוצר פקטור 2. לאחר מכן בודקים סידן. כדי שזה יהיה שוויון, שמים פקטור של 2 לפני החומר המקורי, כתוצאה מכך נקבל את הרשומה:
- 2Ca+O2=2CaO.

ניתוח התגובה בשיטת האיזון האלקטרוני
איך להשוות משוואות כימיות? דוגמאות של RIAs יעזרו לענות על שאלה זו. נניח שיש צורך למקם את המקדמים בתכנית המוצעת בשיטת האיזון האלקטרוני:
- CuO + H2=Cu + H2O.
מלכתחילה, עבור כל אחד מהיסודות בחומרים ההתחלתיים ובתוצרי האינטראקציה, נציב את ערכי מצבי החמצון. לקבל התצוגה הבאהמשוואות:
- Cu(+2)O(-2)+H2(0)=Cu(0)+H2(+)O(-2).
האינדיקטורים השתנו עבור נחושת ומימן. על בסיסם נערוך איזון אלקטרוני:
- Cu(+2)+2e=Cu(0) 1 חומר מפחית, חמצון;
- H2(0)-2e=2H(+) 1 חומר מחמצן, הפחתה.
בהתבסס על המקדמים המתקבלים במאזן האלקטרוני, אנו מקבלים את התיעוד הבא של המשוואה הכימית המוצעת:
- CuO+H2=Cu+H2O.
ניקח דוגמה נוספת שכוללת קביעת מקדמים:
- H2+O2=H2O.
על מנת להשוות תכנית זו על בסיס חוק שימור החומרים, יש צורך להתחיל בחמצן. בהתחשב בכך שמולקולה דיאטומית נכנסה לתגובה, יש צורך לשים פקטור של 2 לפני הנוסחה של תוצר האינטראקציה.
- 2H2+O2=2H2O.

סיכום
בהתבסס על המאזן האלקטרוני, אתה יכול למקם את המקדמים בכל משוואות כימיות. בוגרי כיתות ט' ויא' של מוסדות חינוך, בחירת בחינה בכימיה, באחת המשימות מבחנים אחרוניםלהציע משימות דומות.
קיימות מספר שיטות לקביעת המקדמים במשוואות של תגובות חיזור. אנו משתמשים בשיטת האיזון האלקטרוני, בה הידור של משוואת ה-OVR המלאה מתבצע ברצף הבא:
1. ערכו סכימת תגובה, המציינת את החומרים שהגיבו ואת החומרים הנובעים מהתגובה, למשל:
2. קבע את מצב החמצון של אטומים ורשום את סימן וערכו מעל סמלי היסודות, מסמן את היסודות שמצב החמצון שלהם השתנה:
3. רשמו את המשוואות האלקטרוניות של תגובות החמצון וההפחתה, קבעו את מספר האלקטרונים שנתרם על ידי הגורם המחמצן והתקבל על ידי הגורם המחמצן, ולאחר מכן השווה אותם על ידי הכפלה במקדמים המתאימים:
4. המקדמים המתקבלים התואמים את המאזן האלקטרוני מועברים למשוואה הראשית:
5. השווה את מספר האטומים והיונים שאינם משנים את דרגת החמצון (ברצף: מתכות, לא מתכות, מימן):
6. בדקו את נכונות בחירת המקדמים לפי מספר אטומי החמצן בחלק השמאלי והימני של משוואת התגובה - עליהם להיות שווים (במשוואה זו 24 = 18 + 2 + 4, 24 = 24).
בואו נסתכל על דוגמה מורכבת יותר:
בואו נקבע את מצבי החמצון של אטומים במולקולות:
אנו מרכיבים את המשוואות האלקטרוניות לתגובות של חמצון והפחתה ומשווים את מספר האלקטרונים הנתונים והמתקבלים:
נעביר את המקדמים למשוואה הראשית:
השווה את מספר האטומים שאינם משנים את מצב החמצון:
על ידי ספירת מספר אטומי החמצן בצד ימין ושמאל של המשוואה, אנו מוודאים שהמקדמים נבחרים נכון.
חומרי החמצון והמפחיתים החשובים ביותר
תכונות החיזור של יסודות תלויות במבנה של מעטפת האלקטרונים של אטומים ונקבעות לפי מיקומם במערכת המחזורית של מנדלייב.
מתכות, בעלות 1-3 אלקטרונים ברמת האנרגיה החיצונית, מסירות אותן בקלות ומראות רק תכונות מפחיתות. לא-מתכות (יסודות מקבוצות IV-VII) יכולים גם לתרום וגם לקבל אלקטרונים, כך שהם יכולים להפגין תכונות מצמצמות וגם מחמצנות. בתקופות עם עלייה במספר הסידורי של היסוד, התכונות המפחיתות של חומרים פשוטים נחלשות, והמחמצנות מתגברות. בקבוצות עם עלייה במספר הסידורי, התכונות המפחיתות משופרות, ותכונות החמצון נחלשות. בדרך זו, מחומרים פשוטים, חומרי ההפחתה הטובים ביותר הם מתכות אלקליות, אלומיניום, מימן, פחמן; חומרי החמצון הטובים ביותר הם הלוגנים וחמצן.
תכונות החיזור של חומרים מורכבים תלויות במידת החמצון של האטומים המרכיבים את הרכבם. חומרים המכילים אטומים בעלי מצב החמצון הנמוך ביותר מציגים תכונות מפחיתות. חומרי ההפחתה החשובים ביותר הם פחמן חד חמצני.  , מימן גופרתי
, מימן גופרתי  , ברזל(II) סולפט
, ברזל(II) סולפט  .חומרים המכילים אטומים בעלי מצב החמצון הגבוה ביותר מציגים תכונות חמצון. חומרי החמצון החשובים ביותר הם אשלגן פרמנגנט
.חומרים המכילים אטומים בעלי מצב החמצון הגבוה ביותר מציגים תכונות חמצון. חומרי החמצון החשובים ביותר הם אשלגן פרמנגנט  , אשלגן דיכרומט
, אשלגן דיכרומט  , מי חמצן
, מי חמצן  , חומצה חנקתית
, חומצה חנקתית  , חומצה גופרתית מרוכזת
, חומצה גופרתית מרוכזת  .
.
חומרים המכילים אטומים עם מצב חמצון בינוני יכולים להתנהג כחומרים מחמצנים או מפחיתים.בהתאם לתכונות החומרים איתם הם מתקשרים, ותנאי התגובה. אז בתגובה עם  חומצה גופרתית מציגה תכונות מפחיתות:
חומצה גופרתית מציגה תכונות מפחיתות:
וכאשר אינטראקציה עם מימן גופרתי, הוא חומר מחמצן:

בנוסף, עבור חומרים כאלה, תגובות חמצון-עצמי-התאוששות אפשריות, המתרחשות עם עליה וירידה בו-זמנית במידת החמצון של אטומים של אותו יסוד, למשל:
החוזק של חומרים מחמצנים ומפחיתים רבים תלוי ב-pH של המדיום. לדוגמה, 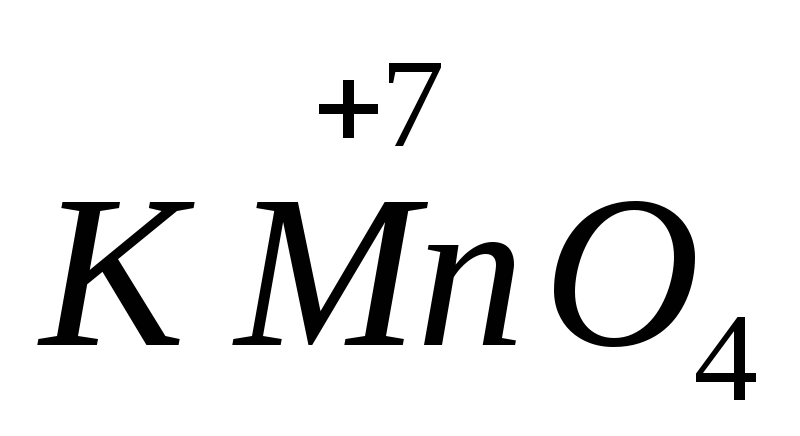 בסביבה בסיסית מצטמצם ל
בסביבה בסיסית מצטמצם ל  , בניוטרל ל
, בניוטרל ל  , בנוכחות חומצה גופרתית - עד
, בנוכחות חומצה גופרתית - עד  .
.
משוואת התגובה הפשוטה ביותר היא:
Fe + S => FeS
משוואת התגובה חייבת להיות מסוגלת לא רק לכתוב, אלא גם לקרוא. המשוואה הזו בגרסתה הפשוטה ביותר נכתבת כך: מולקולת ברזל מקיימת אינטראקציה עם מולקולת גופרית, מתקבלת מולקולה אחת של גופרית ברזל.
הדבר הקשה ביותר בכתיבת משוואת תגובה הוא לכתוב נוסחאות לתוצרי התגובה, כלומר. נוצרו חומרים. יש כאן רק כלל אחד: הנוסחאות של מולקולות בנויות אך ורק לפי הערכיות של היסודות המרכיבים אותן.
בנוסף, כשמרכיבים משוואות תגובה יש לזכור את חוק השימור של מסת החומרים: כל האטומים של המולקולות של החומרים הראשוניים חייבים להיות חלק מהמולקולות של תוצרי התגובה. אף אטום לא צריך להיעלם או להופיע פתאום. לכן, לפעמים, לאחר שכתבו את כל הנוסחאות במשוואת התגובה, יש צורך להשוות את מספר האטומים בכל חלק של המשוואה - לסדר את המקדמים. הנה דוגמה:
C + O 2 => CO 2כאן, לכל יסוד יש אותו מספר של אטומים בצד ימין ובצד שמאל של המשוואה. המשוואה מוכנה.
Cu+O 2 => CuO
וכאן יש יותר אטומי חמצן בצד שמאל של המשוואה מאשר בצד ימין. צריך כל כך הרבה מולקולות תחמוצת נחושת כדי לקבל
CuO , כך שהם מכילים את אותו מספר של אטומי חמצן, כלומר 2. לכן, לפני הנוסחהСuО קבע פקטור 2:Cu+O2 => 2 CuO
כעת מספר אטומי הנחושת אינו זהה. בצד שמאל של המשוואה, לפני סימן הנחושת, שמים את המקדם 2:
2 Cu+O2 => 2 CuO
ספור האם האטומים של כל יסוד שווים בצד שמאל וימין של המשוואה. אם כן, אז משוואת התגובה נכונה.
עוד דוגמה אחת: Al+O 2 = אל 2 O 3
והנה האטומים של כל יסוד כמות שונהלפני ואחרי התגובה. אנחנו מתחילים להשוות עם גז - עם מולקולות חמצן:
1 נשאר 2 אטומי חמצן, ומימין 3. אנו מחפשים את הכפולה הפחות משותפת של שני המספרים הללו. זה המספר הקטן ביותר, שמתחלק גם ב-2 וגם ב-3, כלומר 6. לפני הנוסחאות של חמצן ותחמוצת אלומיניוםאל 2 O 3 להגדיר את המקדמים כך מספר כוללהיו 6 אטומי חמצן במולקולות האלה:
Al+ 3O2= 2Al2O 3
2) אנו סופרים את מספר אטומי האלומיניום: אטום אחד משמאל, ו-2 אטומים מימין בשתי מולקולות, כלומר 4. לפני הסימן של אלומיניום בצד שמאל של המשוואה, שמים את המקדם 4:
4 אל + 3O 2 => 2 Al2O3
3) שוב, אנו סופרים את כל האטומים לפני ואחרי התגובה: 4 אטומי אלומיניום ו-6 אטומי חמצן כל אחד.
הכל מסודר, משוואת התגובה נכונה. ואם התגובה ממשיכה בעת חימום, אז מוצב בנוסף שלט מעל החץט .
המשוואה של תגובה כימית היא תיעוד של מהלך התגובה הכימית באמצעות נוסחאות ומקדמים כימיים.