המוצרים הראשונים העשויים מברזל וסגסוגותיו נמצאו במהלך חפירות ומתוארכים בערך לאלף הרביעי לפני הספירה. כלומר, אפילו המצרים והשומרים הקדמונים השתמשו במרבצי מטאוריטים של חומר זה לייצור תכשיטים וחפצי בית, כמו גם כלי נשק.
כיום, סוגים שונים של תרכובות ברזל, כמו גם מתכת טהורה, הם החומרים הנפוצים והמשומשים ביותר. לא פלא שהמאה ה-20 נחשבה לברזל. אחרי הכל, לפני הופעתו והשימוש הנרחב בפלסטיק וחומרים נלווים, תרכובת זו הייתה בעלת חשיבות מכרעת עבור בני האדם. מהו יסוד זה ואיזה חומרים הוא יוצר, נשקול במאמר זה.
יסוד כימי ברזל
אם ניקח בחשבון את מבנה האטום, אז קודם כל עלינו לציין את מיקומו במערכת המחזורית.
- מספר סידורי - 26.
- התקופה היא הרביעית הגדולה.
- הקבוצה השמינית, תת-הקבוצה המשנית.
- המשקל האטומי הוא 55.847.
- המבנה של מעטפת האלקטרון החיצונית מסומן בנוסחה 3d 6 4s 2.
- הסמל של היסוד הכימי הוא Fe.
- השם ברזל, הקריאה בנוסחה היא "פררום".
- בטבע, ישנם ארבעה איזוטופים יציבים של היסוד המדובר עם מספרי המסה 54, 56, 57, 58.
ליסוד הכימי ברזל יש גם כ-20 איזוטופים שונים שאינם יציבים. מצבי החמצון האפשריים שאטום נתון יכול להפגין הם:
לא רק היסוד עצמו חשוב, אלא גם תרכובותיו וסגסוגותיו השונות.
תכונות גשמיות
כחומר פשוט, לברזל יש מתכתיות בולטת. כלומר, מדובר במתכת כסופה-לבנה בעלת גוון אפור, בעלת דרגת גמישות וגמישות גבוהה ונקודת התכה ורתיחה גבוהה. אם נשקול את המאפיינים ביתר פירוט, אז:
- נקודת התכה - 1539 0 С;
- רותח - 2862 0 C;
- פעילות - ממוצע;
- עקשנות - גבוהה;
- מציג תכונות מגנטיות מובהקות.
בהתאם לתנאים ולטמפרטורות שונות, ישנם מספר שינויים שיוצר ברזל. התכונות הפיזיקליות שלהם שונות מהעובדה ששריגי הגביש שונים.
לכל השינויים יש סוגים שוניםמבנים של סריג קריסטל, וגם שונים תכונות מגנטיות.
תכונות כימיות
כאמור לעיל, החומר הפשוט ברזל מפגין פעילות כימית בינונית. עם זאת, במצב מפוזר דק, הוא מסוגל להצתה עצמית באוויר, והמתכת עצמה נשרפת בחמצן טהור.
יכולת הקורוזיה גבוהה ולכן הסגסוגות של חומר זה מצופות בתרכובות סגסוגות. ברזל מסוגל ליצור אינטראקציה עם:
- חומצות;
- חמצן (כולל אוויר);
- אפור;
- הלוגנים;
- כאשר מחומם - עם חנקן, זרחן, פחמן וסיליקון;
- עם מלחים של מתכות פחות פעילות, הפחתתם לחומרים פשוטים;
- עם אדי מים חדים;
- עם מלחי ברזל במצב חמצון +3.
ברור שעם פעילות כזו, המתכת מסוגלת ליצור תרכובות שונות, מגוונות וקוטביות בתכונותיהן. וכך זה קורה. הברזל ותרכובותיו מגוונים ביותר ומשמשים בענפים שונים של מדע, טכנולוגיה ופעילות אנושית תעשייתית.
תפוצה בטבע
תרכובות ברזל טבעיות נפוצות למדי, מכיוון שזהו היסוד השני בשכיחותו על הפלנטה שלנו אחרי אלומיניום. יחד עם זאת, בצורתה הטהורה, המתכת נדירה ביותר, כחלק ממטאוריטים, מה שמעיד על הצטברויותיה הגדולות בחלל. המסה העיקרית כלולה בהרכב העפרות, סלעיםומינרלים.

אם לדבר על אֲחוּזִיםנחשב אלמנט בטבע, אז ניתן לתת את הדמויות הבאות.
- הליבות של כוכבי הלכת הארציים - 90%.
- בקרום כדור הארץ - 5%.
- במעטפת כדור הארץ - 12%.
- בליבת כדור הארץ - 86%.
- במי נהר - 2 מ"ג/ליטר.
- בים ובאוקיינוס - 0.02 מ"ג לליטר.
תרכובות הברזל הנפוצות ביותר יוצרות את המינרלים הבאים:
- מגנטיט;
- לימוניט או עפרת ברזל חומה;
- vivianite;
- פיררוטיט;
- פיריט;
- סידרייט;
- מרקסיט;
- lellingite;
- mispikel;
- מילנטריט ואחרים.
זו עדיין רשימה ארוכה, כי יש באמת הרבה כאלה. בנוסף, סגסוגות שונות שנוצרו על ידי האדם נפוצות. אלה גם תרכובות ברזל כאלה, שבלעדיהם קשה לדמיין חיים מודרניםשל אנשים. אלה כוללים שני סוגים עיקריים:
- ברזל יצוק;
- הפכו.
ברזל הוא גם תוספת חשובה לסגסוגות ניקל רבות.
תרכובות ברזל(II).
אלה כוללים את אלה שבהם מצב החמצון של היסוד היוצר הוא +2. הם רבים למדי, מכיוון שהם כוללים:
- תַחמוֹצֶת;
- הידרוקסיד;
- תרכובות בינאריות;
- מלחים מורכבים;
- תרכובות מורכבות.
נוסחאות תרכובות כימיות, שבו ברזל מציג את דרגת החמצון המצוינת, הוא אינדיבידואלי עבור כל מחלקה. שקול את החשוב והמשותף שבהם.

ברזל ידוע יסוד כימי. הוא שייך למתכות עם תגובתיות ממוצעת. נשקול את המאפיינים והשימוש של ברזל במאמר זה.
שכיחות בטבע
יש די מספר גדול שלמינרלים המכילים פרום. קודם כל, זה מגנט. זה שבעים ושניים אחוז ברזל. הנוסחה הכימית שלו היא Fe 3 O 4. מינרל זה נקרא גם עפרת ברזל מגנטית. יש לו צבע אפור בהיר, לפעמים עם אפור כהה, עד שחור, עם ברק מתכתי. הפיקדון הגדול ביותר שלה מבין מדינות חבר העמים ממוקם באזור אוראל.
המינרל הבא עם תכולת ברזל גבוהה הוא המטיט - הוא מורכב משבעים אחוז מהיסוד הזה. הנוסחה הכימית שלו היא Fe 2 O 3. זה נקרא גם עפרת ברזל אדומה. יש לו צבע מאדום-חום עד אדום-אפור. הפיקדון הגדול ביותר בשטח מדינות חבר העמים ממוקם ב- Krivoy Rog.
המינרל השלישי מבחינת תכולת הפרום הוא לימוניט. כאן, ברזל הוא שישים אחוז מהמסה הכוללת. זהו הידרט גבישי, כלומר, בה סריג קריסטלמולקולות מים שזורות זו בזו, הנוסחה הכימית שלה היא Fe 2 O 3 .H 2 O. כפי שהשם מרמז, למינרל זה צבע צהוב-חום, לעיתים חום. זהו אחד המרכיבים העיקריים של אוקר טבעי ומשמש כפיגמנט. זה נקרא גם אבן ברזל חומה. ההתרחשויות הגדולות ביותר הן חצי האי קרים, אוראל.
ב-siderit, מה שנקרא עפרת ברזל ספיר, ארבעים ושמונה אחוזים של פררום. הנוסחה הכימית שלו היא FeCO 3 . המבנה שלו הטרוגני ומורכב מגבישים המחוברים זה לזה צבע שונה: אפור, ירוק חיוור, אפור-צהוב, חום-צהוב וכו'.
המינרל האחרון הקיים באופן טבעי עם תכולת פרום גבוהה הוא פיריט. יש לו את הנוסחה הכימית הבאה FeS 2 . הברזל בו הוא ארבעים ושישה אחוזים מהמסה הכוללת. בשל אטומי הגופרית, למינרל זה צבע צהוב זהוב.
רבים מהמינרלים הנחשבים משמשים להשגת ברזל טהור. בנוסף, המטיט משמש לייצור תכשיטים מאבנים טבעיות. תכלילים של פיריט ניתן למצוא בתכשיטי לאפיס לזולי. בנוסף, ברזל נמצא בטבע בהרכב של אורגניזמים חיים - הוא אחד המרכיבים החשובים ביותר של התא. יסוד קורט זה חייב להיות מסופק לגוף האדם בכמות מספקת. סגולות רפואיותברזל נובע בעיקר מהעובדה שהיסוד הכימי הזה הוא הבסיס להמוגלובין. לכן, לשימוש ב-ferrum יש השפעה טובה על מצב הדם, ולכן על האורגניזם כולו בכללותו.
ברזל: תכונות פיזיקליות וכימיות
בואו נסתכל על שני הסעיפים העיקריים האלה לפי הסדר. ברזל הוא המראה שלו, צפיפותו, נקודת ההתכה וכו'. כלומר, כל המאפיינים הייחודיים של חומר הקשורים לפיזיקה. התכונות הכימיות של הברזל הן יכולתו להגיב עם תרכובות אחרות. נתחיל עם הראשון.
תכונות פיזיקליות של ברזל
בצורתו הטהורה בתנאים רגילים, הוא מוצק. יש לו צבע אפור כסוף וברק מתכתי בולט. התכונות המכניות של הברזל כוללות את רמת הקשיות בסולם Mohs. זה שווה לארבע (בינוני). לברזל מוליכות חשמלית ותרמית טובה. ניתן להרגיש את התכונה האחרונה על ידי נגיעה בחפץ ברזל בחדר קר. מכיוון שחומר זה מוליך חום במהירות, הוא מוציא הרבה ממנו מהעור שלך בזמן קצר, וזו הסיבה שאתה מרגיש קר.  נגיעה, למשל, בעץ, ניתן לציין שהמוליכות התרמית שלו נמוכה בהרבה. התכונות הפיזיקליות של הברזל הן נקודות ההיתוך והרתיחה שלו. הראשון הוא 1539 מעלות צלזיוס, השני הוא 2860 מעלות צלזיוס. ניתן להסיק שהמאפיינים האופייניים של ברזל הם גמישות טובה והתמזגות. אבל זה לא הכל.
נגיעה, למשל, בעץ, ניתן לציין שהמוליכות התרמית שלו נמוכה בהרבה. התכונות הפיזיקליות של הברזל הן נקודות ההיתוך והרתיחה שלו. הראשון הוא 1539 מעלות צלזיוס, השני הוא 2860 מעלות צלזיוס. ניתן להסיק שהמאפיינים האופייניים של ברזל הם גמישות טובה והתמזגות. אבל זה לא הכל.
גם ב תכונות גשמיותהברזל כולל גם את הפרומגנטיות שלו. מה זה? ברזל, שעליו נוכל לצפות בתכונותיו המגנטיות דוגמאות מעשיותכל יום, היא המתכת היחידה עם סימן היכר ייחודי כזה. זאת בשל העובדה כי חומר זה מסוגל להיות ממוגנט תחת הפעולה של שדה מגנטי. ולאחר סיום פעולתו של האחרון, הברזל, שתכונותיו המגנטיות רק נוצרו, נשאר מגנט במשך זמן רב. ניתן להסביר תופעה זו בכך שבמבנה של מתכת זו ישנם אלקטרונים חופשיים רבים המסוגלים לנוע.
מבחינת כימיה
יסוד זה שייך למתכות של פעילות בינונית. אבל התכונות הכימיות של הברזל אופייניות לכל שאר המתכות (למעט אלו שנמצאות מימין למימן בסדרה האלקטרוכימית). הוא מסוגל להגיב עם סוגים רבים של חומרים.
בואו נתחיל פשוט
Ferrum יוצר אינטראקציה עם חמצן, חנקן, הלוגנים (יוד, ברום, כלור, פלואור), זרחן, פחמן. הדבר הראשון שיש לקחת בחשבון הוא תגובות עם חמצן. כאשר שורפים את הפרום, נוצרות התחמוצות שלו. בהתאם לתנאי התגובה והפרופורציות בין שני המשתתפים, ניתן לגוון אותם. כדוגמה לאינטראקציות כאלה, ניתן לתת את משוואות התגובה הבאות: 2Fe + O 2 = 2FeO; 4Fe + 3O 2 \u003d 2Fe 2 O 3; 3Fe + 2O 2 \u003d Fe 3 O 4. והתכונות של תחמוצת ברזל (הן הפיזיקליות והן הכימיות) יכולות להיות מגוונות, בהתאם למגוון שלה. תגובות מסוג זה מתרחשות כאשר טמפרטורה גבוהה.

הבא הוא האינטראקציה עם חנקן. זה יכול להתרחש גם רק בתנאי חימום. אם ניקח שש שומות ברזל ושומה אחת של חנקן, נקבל שתי שומות של ניטריד ברזל. משוואת התגובה תיראה כך: 6Fe + N 2 = 2Fe 3 N.
בעת אינטראקציה עם זרחן, נוצר פוספיד. כדי לבצע את התגובה, יש צורך ברכיבים הבאים: עבור שלוש שומות של פרום - שומה אחת של זרחן, כתוצאה מכך נוצרת שומה אחת של פוספיד. ניתן לכתוב את המשוואה כך: 3Fe + P = Fe 3 P.
בנוסף, בין תגובות עם חומרים פשוטים, ניתן להבחין גם באינטראקציה עם גופרית. במקרה זה, ניתן להשיג גופרית. העיקרון שבו מתרחש תהליך היווצרות החומר הזה דומה לאלו שתוארו לעיל. כלומר, מתרחשת תגובת הוספה. עבור כל האינטראקציות הכימיות מהסוג הזה, תנאים מיוחדים, בעיקר טמפרטורות גבוהות, לעתים רחוקות יותר - זרזים.
כמו כן נפוצות בתעשייה הכימית תגובות בין ברזל להלוגנים. אלה הם הכלרה, ברומינציה, יוד, הפלרה. כפי שברור משמות התגובות עצמן, זהו תהליך הוספת אטומי כלור/ברום/יוד/פלואור לאטומי פררום ליצירת כלוריד/ברומיד/יודיד/פלואוריד, בהתאמה. חומרים אלו נמצאים בשימוש נרחב בתעשיות שונות. בנוסף, פררום מסוגל לשלב עם סיליקון בטמפרטורות גבוהות. הודות ל תכונות כימיותברזל מגוון, הוא משמש לעתים קרובות בתעשייה הכימית.
פרום וחומרים מורכבים
מחומרים פשוטים, נעבור לאלו שהמולקולות שלהם מורכבות משני יסודות כימיים שונים או יותר. הדבר הראשון שיש להזכיר הוא התגובה של פררום עם מים. להלן התכונות העיקריות של הברזל. כאשר מים מחוממים, הם נוצרים יחד עם ברזל (זה נקרא כך מכיוון שבאינטראקציה עם אותם מים הם יוצרים הידרוקסיד, במילים אחרות, בסיס). לכן, אם לוקחים שומה אחת משני הרכיבים, נוצרים חומרים כמו דו-תחמוצת הברזל ומימן בצורה של גז עם ריח חריף - גם בפרופורציות מולריות של אחד לאחד. ניתן לכתוב את המשוואה עבור תגובה מסוג זה באופן הבא: Fe + H 2 O \u003d FeO + H 2. בהתאם לפרופורציות שבהן שני הרכיבים הללו מעורבבים, ניתן להשיג ברזל דו-או טריאוקסיד. שני החומרים הללו נפוצים מאוד בתעשייה הכימית ומשמשים גם בתעשיות רבות אחרות.
עם חומצות ומלחים
מכיוון שהפררום ממוקם משמאל למימן בסדרה האלקטרוכימית של פעילות המתכת, הוא מסוגל לעקור יסוד זה מתרכובות. דוגמה לכך היא תגובת ההחלפה שניתן לראות כאשר מוסיפים ברזל לחומצה. לדוגמה, אם תערבבו ברזל וחומצה גופרתית (המכונה חומצה גופרתית) בריכוז בינוני באותן פרופורציות מולריות, התוצאה תהיה ברזל גופרתי (II) ומימן באותם פרופורציות טוחנות. המשוואה לתגובה כזו תיראה כך: Fe + H 2 SO 4 \u003d FeSO 4 + H 2.
בעת אינטראקציה עם מלחים, התכונות המפחיתות של הברזל באות לידי ביטוי. כלומר, בעזרתו ניתן לבודד מתכת פחות פעילה ממלח. לדוגמה, אם אתה לוקח שומה אחת ואותה כמות של פרום, אז אתה יכול לקבל ברזל סולפט (II) ונחושת טהורה באותם פרופורציות טוחנות.
משמעות לגוף
אחד היסודות הכימיים הנפוצים ביותר בקרום כדור הארץ הוא ברזל. כבר שקלנו, עכשיו ניגש לזה מנקודת מבט ביולוגית. Ferrum מבצע פונקציות חשובות מאוד הן ברמת התא והן ברמת האורגניזם כולו. קודם כל, ברזל הוא הבסיס לחלבון כזה כמו המוגלובין. זה הכרחי להובלת חמצן דרך הדם מהריאות לכל הרקמות, האיברים, לכל תא בגוף, בעיקר לנוירונים של המוח. בגלל זה תכונות מועילותאי אפשר להפריז בברזל.
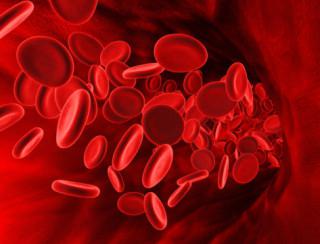
בנוסף לעובדה שהוא משפיע על יצירת הדם, הפררום חשוב גם לתפקוד מלא של בלוטת התריס(זה דורש לא רק יוד, כפי שיש הסבורים). ברזל גם לוקח חלק בחילוף החומרים התוך תאי, מסדיר את החסינות. פרום נמצא גם בכמויות גדולות במיוחד בתאי הכבד, שכן הוא עוזר לנטרל חומרים מזיקים. זהו גם אחד המרכיבים העיקריים של סוגים רבים של אנזימים בגופנו. התזונה היומית של אדם צריכה להכיל בין עשרה לעשרים מיליגרם של יסוד קורט זה.
מזונות עשירים בברזל
יש הרבה. הם ממקור צמחי ובעלי חיים כאחד. הראשונים הם דגנים, קטניות, דגנים (בעיקר כוסמת), תפוחים, פטריות (לבנים), פירות יבשים, ורדים, אגסים, אפרסקים, אבוקדו, דלעת, שקדים, תמרים, עגבניות, ברוקולי, כרוב, אוכמניות, אוכמניות, סלרי, וכו' השני - כבד, בשר. השימוש במזונות עתירי ברזל חשוב במיוחד במהלך ההיריון, שכן גופו של העובר המתפתח דורש כמות גדולה של יסוד קורט זה לגדילה והתפתחות תקינים.
סימנים של מחסור בברזל בגוף
תסמינים של מעט מדי פרום הנכנס לגוף הם עייפות, הקפאה מתמדת של הידיים והרגליים, דיכאון, שיער וציפורניים שבירים, ירידה בפעילות אינטלקטואלית, הפרעות במערכת העיכול, ביצועים נמוכים והפרעות בבלוטת התריס. אם אתה מבחין ביותר מאחד מהתסמינים הללו, ייתכן שתרצה להגדיל את כמות המזונות העשירים בברזל בתזונה שלך או לקנות ויטמינים או תוספי מזון המכילים פרום. כמו כן, הקפד להתייעץ עם רופא אם אחד מהתסמינים הללו אתה מרגיש חריף מדי. 
השימוש בפררום בתעשייה
השימושים והמאפיינים של הברזל קשורים קשר הדוק. בשל הפרומגנטיות שלו, הוא משמש לייצור מגנטים - גם חלשים יותר למטרות ביתיות (מגנטים למקרר למזכרות וכו'), וגם חזקים יותר - למטרות תעשייתיות. בשל העובדה שלמתכת המדוברת חוזק וקשיות גבוהים, היא שימשה מאז ימי קדם לייצור נשק, שריון וכלים צבאיים וביתיים אחרים. אגב, אפילו במצרים העתיקה היה ידוע ברזל מטאוריט, שתכונותיו עדיפות על אלו של מתכת רגילה. כמו כן, נעשה שימוש במגהץ מיוחד כזה רומא העתיקה. הם יצרו ממנו נשק עילית. רק אדם עשיר ואציל מאוד יכול להיות בעל מגן או חרב עשויים מתכת מטאוריט.

באופן כללי, המתכת שאנו שוקלים במאמר זה היא המגוונת ביותר מבין כל החומרים בקבוצה זו. קודם כל מייצרים ממנו פלדה וברזל יצוק, המשמשים לייצור כל מיני מוצרים הדרושים הן בתעשייה והן בחיי היום יום.
ברזל יצוק הוא סגסוגת של ברזל ופחמן, שבה השני קיים בין 1.7 ל-4.5 אחוזים. אם השני הוא פחות מ-1.7 אחוז, אז סוג זה של סגסוגת נקרא פלדה. אם קיים כ-0.02 אחוז מהפחמן בהרכב, אז זה כבר ברזל טכני רגיל. הנוכחות של פחמן בסגסוגת נחוצה כדי להעניק לה חוזק רב יותר, יציבות תרמית ועמידות בפני חלודה.
בנוסף, פלדה יכולה להכיל יסודות כימיים רבים אחרים כזיהומים. זה מנגן, זרחן וסיליקון. כמו כן, ניתן להוסיף לסוג זה של סגסוגת כרום, ניקל, מוליבדן, טונגסטן ואלמנטים כימיים רבים אחרים כדי להעניק לו איכויות מסוימות. סוגי פלדה בהם מצויה כמות גדולה של סיליקון (כארבעה אחוזים) משמשים כפלדות שנאי. אלה המכילים הרבה מנגן (עד שנים עשר עד ארבעה עשר אחוז) מוצאים את השימוש שלהם בייצור חלקים מסילות ברזל, טחנות, מגרסה וכלים אחרים, שחלקים מהם נתונים לשחיקה מהירה.
מוליבדן מוכנס להרכב הסגסוגת כדי להפוך אותו ליציב יותר מבחינה תרמית - פלדות כאלה משמשות כפלדות כלי עבודה. בנוסף, על מנת להשיג פלדות אל-חלד מוכרות ולרוב בשימוש בחיי היום-יום בצורת סכינים וכלי בית אחרים, יש צורך להוסיף לסגסוגת כרום, ניקל וטיטניום. וכדי לקבל פלדה עמידה בפני זעזועים, חוזק גבוה, רקיע, מספיק להוסיף לה ונדיום. כאשר מוכנס להרכב הניוביום, ניתן להשיג עמידות גבוהה בפני קורוזיה והשפעות של חומרים אגרסיביים מבחינה כימית.
המינרל מגנטיט, שהוזכר בתחילת המאמר, נחוץ לייצור כוננים קשיחים, כרטיסי זיכרון והתקנים אחרים מסוג זה. בשל תכונותיו המגנטיות, ניתן למצוא ברזל בבניית שנאים, מנועים, מוצרים אלקטרוניים ועוד. בנוסף, ניתן להוסיף פררום לסגסוגות מתכת אחרות כדי להעניק להן חוזק ויציבות מכנית רבה יותר. הסולפט של יסוד זה משמש בגננות להדברת מזיקים (יחד עם גופרת נחושת).  חיוניים בטיהור מים. בנוסף, משתמשים באבקת מגנטיט במדפסות שחור-לבן. דרך ראשיתהפיריט משמש לייצור חומצה גופרתית ממנו. תהליך זה מתרחש במעבדה בשלושה שלבים. בשלב הראשון שורפים פיריט פרום לייצור תחמוצת ברזל וגופרית דו חמצנית. בשלב השני, ההמרה של דו תחמוצת הגופרית לטריאוקסיד שלה מתרחשת בהשתתפות חמצן. ובשלב הסופי, החומר המתקבל עובר בנוכחות זרזים, ובכך משיג חומצה גופרתית.
חיוניים בטיהור מים. בנוסף, משתמשים באבקת מגנטיט במדפסות שחור-לבן. דרך ראשיתהפיריט משמש לייצור חומצה גופרתית ממנו. תהליך זה מתרחש במעבדה בשלושה שלבים. בשלב הראשון שורפים פיריט פרום לייצור תחמוצת ברזל וגופרית דו חמצנית. בשלב השני, ההמרה של דו תחמוצת הגופרית לטריאוקסיד שלה מתרחשת בהשתתפות חמצן. ובשלב הסופי, החומר המתקבל עובר בנוכחות זרזים, ובכך משיג חומצה גופרתית.
מקבל ברזל
מתכת זו נכרית בעיקר משני המינרלים העיקריים שלה: מגנטיט והמטייט. זה נעשה על ידי הפחתת ברזל מהתרכובות שלו עם פחמן בצורה של קוק. זה נעשה בתנורי פיצוץ, שהטמפרטורה בהם מגיעה לאלפיים מעלות צלזיוס. בנוסף, יש דרך להפחית את הפרום עם מימן. זה לא מצריך תנור פיצוץ. כדי ליישם שיטה זו, נלקח חימר מיוחד, מעורבב עם עפרות כתוש ומטופל במימן בכבשן פיר.
סיכום
התכונות והשימושים של הברזל מגוונים. זו אולי המתכת החשובה ביותר בחיינו. לאחר שנודע לאנושות, הוא תפס את מקום הברונזה, שבאותה תקופה היה החומר העיקרי לייצור כל הכלים, כמו גם כלי נשק. פלדה וברזל יצוק עדיפים במובנים רבים על סגסוגת הנחושת והפח מבחינת התכונות הפיזיקליות שלהם, העמידות בפני מתח מכני.
בנוסף, ברזל נפוץ יותר על הפלנטה שלנו מאשר מתכות רבות אחרות. זה בקרום כדור הארץ הוא כמעט חמישה אחוזים. זהו היסוד הכימי הרביעי בשכיחותו בטבע. כמו כן, יסוד כימי זה חשוב מאוד לתפקוד תקין של האורגניזם של בעלי חיים וצמחים, בעיקר בגלל שההמוגלובין בנוי על בסיסו. ברזל הוא יסוד קורט חיוני, שהשימוש בו חשוב לשמירה על בריאות ותפקוד תקין של האיברים. בנוסף לאמור לעיל, זוהי המתכת היחידה בעלת תכונות מגנטיות ייחודיות. בלי פרום אי אפשר לדמיין את החיים שלנו.
ברזל הוא יסוד כימי
1. מיקומו של הברזל בטבלה המחזורית של יסודות כימיים ומבנה האטום שלו
ברזל הוא יסוד ד מקבוצה VIII; מספר סידורי - 26; מסה אטומית Ar (Fe ) = 56; הרכב האטום: 26 פרוטונים; 30 - נויטרונים; 26 - אלקטרונים.
סכימה של מבנה האטום:
נוסחה אלקטרונית: 1s 2 2s 2 2p 6 3s 2 3p 6 3d 6 4s 2
מתכת בפעילות בינונית, חומר מפחית:
Fe 0 -2 e - → Fe +2 , החומר המצמצם מתחמצן
Fe 0 -3 e - → Fe +3 , החומר המצמצם מתחמצן
מצבי חמצון עיקריים: +2, +3
2. שכיחות ברזל
ברזל הוא אחד היסודות הנפוצים ביותר בטבע. . בקרום כדור הארץ, חלק המסה שלו הוא 5.1%, לפי אינדיקטור זה, זה שני רק לחמצן, סיליקון ואלומיניום. הרבה ברזל נמצא גם בגרמי שמיים, אשר מבוסס על נתוני ניתוח ספקטרלי. בדגימות של אדמת ירח, אשר נמסרו על ידי התחנה האוטומטית "לונה", נמצא ברזל במצב לא מחומצן.
עפרות ברזל נפוצות למדי על פני כדור הארץ. שמות ההרים באוראל מדברים בעד עצמם: גבוה, מגנטי, ברזל. כימאים חקלאיים מוצאים תרכובות ברזל בקרקעות.
ברזל נמצא ברוב הסלעים. להשגת ברזל משתמשים בעפרות ברזל עם תכולת ברזל של 30-70% ומעלה.
עפרות הברזל העיקריות הן :
מגנטיט(עפרת ברזל מגנטית) - Fe 3 O 4מכיל 72% ברזל, משקעים נמצאים על דרום אוראל, אנומליה מגנטית של קורסק:
|
|
|
המטיט(ברזל, אבן דם) - Fe2O3מכיל עד 65% ברזל, משקעים כאלה נמצאים באזור Krivoy Rog:
|
|
|
לימוניט(עפרת ברזל חומה) - Fe 2 O 3 * nH 2 Oמכיל עד 60% ברזל, פיקדונות נמצאים בחצי האי קרים:

פיריט(פיריט גופרית, פיריט ברזל, זהב של חתול) - FeS 2מכיל כ-47% ברזל, משקעים נמצאים באורל.

3. תפקיד הברזל בחיי האדם והצומח
ביוכימאים גילו תפקיד חשובברזל בחיי הצומח, החי והאדם. בהיותו חלק מתרכובת אורגנית מורכבת ביותר הנקראת המוגלובין, ברזל קובע את הצבע האדום של חומר זה, אשר בתורו קובע את צבע הדם של בני אדם ובעלי חיים. גופו של מבוגר מכיל 3 גרם ברזל טהור, 75% ממנו הם חלק מהמוגלובין. התפקיד העיקרי של המוגלובין הוא העברת חמצן מהריאות לרקמות, ובכיוון ההפוך - CO 2.
צמחים צריכים גם ברזל. זה חלק מהציטופלזמה, משתתף בתהליך הפוטוסינתזה. לצמחים הגדלים על מצע נטול ברזל יש עלים לבנים. תוספת קטנה של ברזל למצע - והם הופכים לירוקים. יתרה מכך, כדאי למרוח סדין לבן בתמיסת מלח המכילה ברזל, ועד מהרה המקום המרוח הופך לירוק.
אז מאותה סיבה - נוכחות של ברזל במיצים ורקמות - עלים של צמחים הופכים לירוקים בעליזות והלחיים של אדם מסמיקות בבהירות.
4. תכונות פיזיקליות של ברזל.
ברזל הוא מתכת כסופה-לבנה עם נקודת התכה של 1539 o C. הוא רקיע מאוד, ולכן הוא מעובד בקלות, מזויף, מגולגל, הטבעה. לברזל יש יכולת להתמגנט ולבטל את המגנט, ולכן הוא משמש כליבות של אלקטרומגנטים במכונות ובמכשירים חשמליים שונים. ניתן להעניק לו חוזק וקשיות גדולים יותר על ידי שיטות של פעולה תרמית ומכאנית, למשל, על ידי מרווה וגלגול.
יש ברזל טהור מבחינה כימית וטכנית. ברזל טהור טכנית, למעשה, הוא פלדה דלת פחמן, היא מכילה 0.02 -0.04% פחמן, ואפילו פחות חמצן, גופרית, חנקן וזרחן. ברזל טהור מבחינה כימית מכיל פחות מ-0.01% זיהומים. ברזל טהור מבחינה כימיתאפור כסוף, מבריק מראה חיצונימתכת דומה מאוד לפלטינה. ברזל טהור מבחינה כימית עמיד בפני קורוזיה ועמיד היטב בפני פעולת החומצות. עם זאת, חלקים לא משמעותיים של זיהומים מונעים ממנו את המאפיינים היקרים הללו.
5. השגת ברזל
התאוששות מתחמוצות עם פחמן או פחמן חד חמצני (II), כמו גם מימן:
FeO + C = Fe + CO
Fe 2 O 3 + 3CO \u003d 2Fe + 3CO 2
Fe 2 O 3 + 3H 2 \u003d 2Fe + 3H 2 O
התנסות ב"השגת ברזל באמצעות אלונותרמיה"
6. תכונות כימיות של ברזל
כמרכיב של תת-קבוצה צדדית, ברזל יכול להפגין מספר מצבי חמצון. נשקול רק תרכובות בהן הברזל מציג מצבי חמצון +2 ו-+3. לפיכך, אנו יכולים לומר שלברזל יש שתי סדרות של תרכובות בהן הוא דו ערכי ותלת ערכי.
1) באוויר, ברזל מתחמצן בקלות בנוכחות לחות (חלודה):
4Fe + 3O 2 + 6H 2 O \u003d 4Fe (OH) 3
2) חוט ברזל מחומם נשרף בחמצן ויוצר אבנית - תחמוצת ברזל (II, III) - חומר שחור:
3Fe + 2O 2 = Fe 3 O 4
גחמצן בצורות אוויר לח Fe 2 O 3 * nH 2 O
התנסות ב"אינטראקציה של ברזל עם חמצן"
3) בטמפרטורות גבוהות (700-900 מעלות צלזיוס), ברזל מגיב עם אדי מים:
3Fe + 4H 2 O t˚C → Fe 3 O 4 + 4H 2
4) ברזל מגיב עם לא-מתכות כאשר הוא מחומם:
Fe + S t˚C → FeS
5) ברזל מתמוסס בקלות בחומצות הידרוכלוריות ובחומצות גופריתיות מדוללות בתנאים רגילים:
Fe + 2HCl \u003d FeCl 2 + H 2
Fe + H 2 SO 4 (הבדל) \u003d FeSO 4 + H 2
6) בחומצות מרוכזות - חומרי חמצון, ברזל מתמוסס רק בחימום
2Fe + 6H 2 SO 4 (ריכוז .) t˚C → Fe 2 (SO 4) 3 + 3SO 2 + 6H 2 O
Fe + 6HNO 3 (ריכוז .) t˚C → Fe(NO 3) 3 + 3NO 2 + 3H 2 Oברזל(III)
7. השימוש בברזל.
עיקר הברזל המיוצר בעולם משמש לייצור ברזל ופלדה – סגסוגות ברזל עם פחמן ומתכות אחרות. ברזל יצוק מכיל כ-4% פחמן. פלדות מכילות פחות מ-1.4% פחמן.
דרוש ברזל יצוק לייצור יציקות שונות - מיטות של מכונות כבדות וכו'.
מוצרי ברזל יצוק
פלדות משמשות לייצור מכונות, חומרי בניין שונים, קורות, יריעות, מוצרים מגולגלים, מסילות, כלים ומוצרים רבים אחרים. לייצור דרגות שונות של פלדה, נעשה שימוש בתוספי סגסוג כביכול, שהם מתכות שונות: M
סימולטור №2 - Fe 3+ סדרה גנטית
סימולטור מס' 3 - משוואות לתגובות ברזל עם חומרים פשוטים ומורכבים
משימות לתיקון
מס' 1. הרכיבו את המשוואות לתגובות השגת ברזל מהתחמוצות שלו Fe 2 O 3 ו- Fe 3 O 4 תוך שימוש כחומר מפחית:
א) מימן;
ב) אלומיניום;
ג) פחמן חד חמצני (II).
עבור כל תגובה, ערכו מאזן אלקטרוני.
מס' 2. בצע את השינויים לפי הסכימה:
Fe 2 O 3 -> Fe - + H2O, t -> X - + CO, t -> Y - + HCl -> Z
תן שם למוצרים X, Y, Z?
ברזל מפגין פעילות כימית מתונה. הוא נשרף באווירת חמצן, ויוצר תחמוצת Fe 2 O 3. במצב מחולק דק, המתכת היא פירופורית; בעל יכולת בעירה ספונטנית באוויר. ניתן להשיג אבקה דקה של ברזל על ידי פירוק תרמי של ברזל אוקסלט באווירת מימן.
כאשר הוא מאוחסן באוויר בטמפרטורות של עד 200 מעלות צלזיוס, הברזל מכוסה בהדרגה בסרט צפוף של תחמוצת, המונע חמצון נוסף של המתכת. באוויר לח, הברזל מכוסה בשכבת חלודה רופפת, שאינה מונעת גישה של חמצן ולחות למתכת והרס שלה. לחלודה אין הרכב כימי קבוע, בערך שלה נוסחה כימיתניתן לכתוב בתור Fe 2 O 3.
ברזל מגיב עם גופרית מותכת, יוצר גופרית, אינטראקציה פעילה עם כלור, ברום ויוד ליצירת טריכלוריד, טריברומיד ודייודיד. ברזל מגיב חלש עם פלואור עקב היווצרות סרט צפוף ונמוך נדיף של טריפלואור על פני השטח. בטמפרטורות מעל 500 מעלות צלזיוס, המתכת מקיימת אינטראקציה הפיכה עם פחמן:
קרביד ברזל בהרכב זה נקרא צמנטיט. הוא נמצא בברזל יצוק ובפלדות.
ברזל מגיב עם חמצן כאשר הוא מחומם. כאשר ברזל נשרף באוויר, נוצרת תחמוצת Fe 2 O 3; כאשר נשרף בחמצן טהור, נוצרת תחמוצת Fe 3 O 4. כאשר חמצן או אוויר מועברים דרך ברזל מותך, נוצרת תחמוצת FeO.
כאשר מחומם, ברזל מגיב עם חנקן, יוצר ברזל ניטריד Fe3N, עם זרחן, יוצר פוספידים FeP, Fe 2 P ו- Fe 3 P, עם פחמן, ויוצר Fe 3 C קרביד, עם סיליקון, ויוצר מספר סיליקידים, למשל, FeSi. בְּ לחץ דם גבוהברזל מתכתי מגיב עם פחמן חד חמצני CO, ונוזל, בתנאים רגילים, נוצר ברזל פנטקרבוניל נדיף בקלות Fe (CO) 5. ידועים גם קרבונילי ברזל בהרכבים Fe 2 (CO) 9 ו- Fe 3 (CO) 12. קרבונילי ברזל משמשים כחומרי מוצא בסינתזה של תרכובות ברזל אורגנו, כולל הרכב פרוצין.
ברזל מתכתי טהור יציב במים ובתמיסות אלקליות מדוללות. בחומצות גופריתיות וחנקתיות מרוכזות, ברזל אינו מתמוסס, מכיוון שסרט תחמוצת חזק מפסיב את פני השטח שלו. עם חומצות גופרתיות הידרוכלוריות ומדוללות (כ-20%), ברזל מגיב ליצירת מלחי ברזל(II):
Fe + 2HCl \u003d FeCl 2 + H 2
Fe + H 2 SO 4 \u003d FeSO 4 + H 2
כאשר ברזל יוצר אינטראקציה עם כ-70% חומצה גופרתית, התגובה ממשיכה עם היווצרות של ברזל (III) סולפט:
2Fe + 4H 2 SO 4 \u003d Fe 2 (SO 4) 3 + SO 2 + 4H 2 O
בהשפעת לחות אטמוספרית ואוויר, ברזל משחית (חלודה):
4Fe + 2H 2 O + 3O 2 \u003d 4FeO (OH)
עד 10% מכלל הברזל המיוצר הולך לאיבוד מדי שנה עקב קורוזיה.
ברזל טהור מאוד, המכיל פחות מ-0.01% זיהומי גופרית, פחמן וזרחן, עמיד בפני קורוזיה. ליד העיר דלהי בהודו ישנו עמוד ברזל, שהוקם כבר במאה ה-9. לפני הספירה, שאין עליה סימני חלודה. הוא עשוי ממתכת טהורה מאוד עם תכולת ברזל של 99.72%. לא התפקיד האחרון בעמידות בפני קורוזיה של החומר של העמוד המפורסם יכול להיות משחק על ידי התכונות האקלימיות של אזור זה.
ברזל מתכתי יוצר אינטראקציה כאשר מחומם עם תמיסות אלקליות מרוכזות (יותר מ-30%), ויוצרות קומפלקסים של הידרוקסו. תחת פעולתם של חומרי חמצון חזקים, כאשר מחומם, ברזל יכול ליצור תרכובות במצב חמצון (+ VI) - פראטים:
Fe + 2KNO 3 = K 2 FeO 4 + 2NO
עבור ברזל, ידועים תחמוצות והידרוקסידים במצבי חמצון (II) ו-(III).
ברזל יוצר מלחים פשוטים עם כמעט כל האניונים. מסיסים במים הם ניטרטים, סולפטים, הלידים (למעט פלואורידים), אצטט וכו'. ניתן לחמצן את קטיון הברזל(II) על ידי חומרי חמצון רבים לקטיון הברזל(III). תמיסות של מלחי ברזל(II) ומלחיו המוצקים מתחמצנים בהדרגה גם כשהם מאוחסנים באוויר:
4FeCO 3 + 2H 2 O + O2 = 4FeO(OH) + 2CO 2
4FeS + 6H 2 O + O 2 \u003d 4FeO (OH) + 4H 2 S
מלח הברזל המוצק(II) היציב ביותר הוא ברזל(II)-אמוניום סולפט hexahydrate (NH4)2Fe(SO 4)2.6H 2 O (מלח מוהר).
בחימום מתפרקים סולפטים, חנקות, קרבונטים ואוקסלטים של ברזל. במקרה זה, ברזל (II) מחומצן בדרך כלל לברזל (III), למשל:
2FeSO 4 \u003d Fe 2 O 3 + SO 3 + SO 2
מלחי ברזל(III) עוברים הידרוליזה חזקה.
הוא מרכיב בהמוגלובין. חלבון מורכב זה נמצא בתאי דם אדומים, הידועים גם בתור תאי דם אדומים. בלעדיהם, למעשה, הדם לא יהיה ארגמן, ולא יהיו חיים.
תאי דם אדומים מעבירים פחמן דו חמצני וחמצן בכל הגוף. הם חיוניים לחיים. מה עוד צריך בַּרזֶל, מהן תכונותיו ועלותו במובן המילולי והפיגורטיבי?
תכונות כימיות ופיזיקליות של ברזל
נגעת בברזל בחדר קריר? הקור מהמגע במתכת הוא תוצאה של מוליכות תרמית גבוהה שלה. החומר לוקח את האנרגיה של הגוף באופן מיידי ומעביר אותה סביבה. כתוצאה מכך, האדם הופך קר.
מוליכות חשמלית של ברזלגם ברמה הגבוהה ביותר. המתכת מעבירה בקלות זרם עקב האלקטרונים החופשיים באטום. יש לו 7 שכבות. לשני האחרונים יש 8 אלקטרונים. כאשר הם נרגשים, כולם יכולים להיות ערכיים, כלומר מסוגלים ליצור קשרים חדשים.
מבחינה חיצונית ברזל מתכתאפור כסוף. יש צורות מקומיות. ברזל טהורפלסטיק וניתן לגימור. יש לו ברק מתכתי בולט וקשיות ממוצעת של 4 נקודות. 10 נקודות הן אינדיקטור של האבן הקשה ביותר על פני כדור הארץ - יהלום, וטלק מסומן בנקודה אחת.
ברזל הוא יסודקשיחות בינונית. המתכת רותחת ב-2860 מעלות, ומתרככת ב-1539. במצב זה, החומר מאבד את התכונות הפרומגנטיות שלו. הם טבועים רק במצב המוצק של ברזל. האלמנט הופך למגנט כאשר הוא נכנס לשדה.
אבל, יותר מעניין הוא שאחרי היעלמותה, המתכת עדיין במשך זמן רבנשאר מגנט. תכונה זו נובעת מאותם אלקטרונים חופשיים במבנה האטום. בתנועה, החלקיקים משנים את המבנה והתכונות שלו.
ברזל הוא יסוד כימי, מגיב בקלות עם ברום, פלואור, כלור והלוגנים אחרים. אלה הם היסודות של הקבוצה ה-17 של הטבלה המחזורית. בתנאים רגילים, אינטראקציה עם חמצן ממשיכה גם היא.
עכשיו, לגבי תגובות החימום. כאשר מתכת נשרפת נוצרות תחמוצות שלה. ישנם מספר סוגים שלהם: - 2FeO, 2Fe 2 O 3, Fe 3 O 4. איזה מהם יתברר תלוי בפרופורציות של האלמנטים המקוריים ובתנאי השילוב. התכונות של תחמוצות משתנות.

חימום מתחיל ומגיב עם . הוא צריך 6 שומות ברזל ושומה אחת של גז. תשואה - 2 מולים של ניטריד של היסוד ה-26. הפוספיד שלו כבר נוצר בשילוב עם זרחן. חומר פשוט נוסף שמשלב עם ferrum הוא. מתברר, כמובן, גופרית. מתרחשת תגובת הוספה.
מחומרים מורכבים, כלומר מורכבים ממולקולות, ברזל יוצר אינטראקציהעם חומצות. מתכת עוקרת מהם מימן. מסתבר כתחליף. אז, ואינטראקציה עם חומצה גופרתית משאיר ferrum סולפט ומימן טהור.
אפשר גם תגובות עם. הברזל שלהם משחזר. במילים אחרות, היסוד ה-26 משחרר מתכת פחות פעילה מחומרים. על ידי שילוב של פררום, למשל, עם גופרת נחושת, מתקבל ברזל גופרתי. נשאר בצורתו המקורית.
השימוש בברזל
איפה הברזלמיושם, נובע מתכונותיו. פרומגנטיות שימושית בייצור של מזכרות ומתקנים תעשייתיים. במילים אחרות, מגנטים עשויים ממתכת, גם למקררים וגם לתעשיות גדולות. חוזק החומר, קשיות - סיבה להשתמש בו לייצור נשק ושריון.
דגמים מ ברזל מטאורי. בגופים קוסמיים, התכונות של הפרום משופרות. לכן, סכינים ושריון חדים ועמידים במיוחד. סימני ברזלמטאוריט הובחן ברומא העתיקה.
ידוע ו סגסוגות ברזלבמיוחד ברזל יצוק ופלדה. דברים של משק בית, אופי יומיומי נוצקים מהם, למשל, גדרות, גזיבו, אביזרים. Ferrum משמש גם למטרות תעשייתיות. מעניין לציין שההרכב של פלדה וברזל יצוק זהה, הפרופורציות שונות. ושם, ושם מתמזגים ברזל עם פחמן. בפלדה, הגז הוא פחות מ-1.7%. בברזל יצוק, פחמן הוא בין 1.7 ל-4.5%.

פחמן בסגסוגות ברזל משחק תפקיד של אלמנט מחזק. זה מפחית את הרגישות של התערובת לקורוזיה והופך את החומר לעמיד בחום. לפלדות מתווספים גם תוספים אחרים. לא פלא שיש מותגים שונים של סגסוגת. עם, למשל, הם מייצרים פלדה עמידה בפני פגיעות ובו זמנית, רקיעה.
בצורה של כלוריד, היסוד ה-26 משמש לטיהור מים. מתכת שימושית גם ברפואה. טיפול בברזלהכרחי לאנמיה. זהו חוסר בתאי דם אדומים ובמתכת בהרכבם. תכשירי ברזלהם נרשמים גם לחולים עם שחפת, סיאטיקה, הסובלים מפרכוסים ודימום מהאף.
האלמנט ה-26 נחוץ גם לתפקוד תקין של בלוטת התריס. בדרך כלל, חוסר התפקוד שלו קשור למחסור. עם זאת, הוא לא לבד בהבטחת בריאות הבלוטה.
הרבה פררום ובתאי הכבד. שם, המתכת עוזרת לנטרל חומרים מזיקים, רעלים. כדי לשמור על גוף האדם צריך לקבל לפחות 20 מיליגרם ברזל ליום.
כריית ברזל
ברזל הוא מתכת נפוצה. ישנם מינרלים רבים בטבע, המבוססים על היסוד ה-26. הכי ferrum ב ו. מהם, ו להסיר ברזל.
תגובת הפחתת המתכת מתבצעת. לשם כך יש צורך בקוק, כלומר תרכובת של פחמן. האינטראקציה מתרחשת בטמפרטורה של 2000 מעלות צלזיוס, בדומיין.
מוותרים על תנורי פיצוץ בעת שחזור פררום עם מימן טהור. תנורי פיר כבר נדרשים. מה שנקרא מודלים מוארכים אנכית.

חלל העבודה של המכשיר דומה לצילינדר או חרוט. הם שמו מרוסק עפרת ברזל, מעורבב עם מיוחד . לאחר מכן, מוסיפים מימן. התוצאה זהה - פרום טהור.
מחיר ברזל
עלות המתכת תלויה בסוג המוצר. רוב הדברים עשויים מסגסוגות פרום, כגון חומרי קירוי. כיסויי גג הם בדרך כלל גיליון. המחיר למ"ר משתנה בין 300 ליותר מ-600 רובל, תלוי בעובי הברזל.
יריעות קירוי הם גליים, בעלי גיאומטריה מורכבת והרכב מיוחד. שכבות פשוטות זולות יותר. ישנן הצעות לקנות 30 גיליונות 2.5 על 1.3 מטר עבור 1000 רובל. עובי - 1.5 מ"מ.
אלמנט טהור בטבליות עולה בערך 1600 רובל עבור 180-200 חתיכות. אם נרכש מוצר מוכן, שבה מושקעת עבודת כפיים, יכול להיות קשה להחזיק בטווח של עשרות, מאות אלפים. דוגמה בולטת היא מוצרים מזויפים להזמנות בודדות.
עבור שערים יוצאי דופן, רהיטים, אגרטלים, נפחים "שוברים" סכום נכבד. רוב המחיר הוא לא העבודה החומרית, אלא העבודה האנושית, מימוש הרעיון.

באשר לעלות של עפרות נושאות ברזל, כ-40 דולר אמריקאי מתבקשים ברוסיה לטון. זהו תג המחיר לחומרי גלם עם 60 אחוז תכולת פרום. כאשר מבודדת אבקה טהורה של היסוד ה-26, עבור 1000 קילוגרם מבקשים לא פחות מ-560-600 דולר אמריקאי.
רוב החברות מוכרות בסיטונאות. הצעות לקנות רק קילו אחד של מתכת הן נדירות. 1000 גרם עולה בערך 1-1.5 דולר. חלק מהחברות אורזות אבקת פרום בשקיות של 5, 10, 25 קילוגרם. מודעות מכירה שפורסמו באינטרנט.


